
| A. | 常温常压下,2gD2O中含有的电子总数为NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 1mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
分析 A.D2O分子中含有10个电子,计算2g重水的物质的量为得到电子数;
B.红热的铁与水蒸气可发生反应:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,0.3molFe粉与足量水蒸气反应,生成0.4molH2;
C.K原子最外层一个电子与足量氧气反应电子转移1mol;
D.氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中的氢离子是水电离的,则水电离的氢氧根离子浓度=氢离子浓度=1×10-13mol/L;
解答 解:A.D2O分子中含有10个电子,2g重水的物质的量为$\frac{2g}{20g/mol}$=0.1mol,含有1mol电子,故A正确;
B.红热的铁与水蒸气可发生反应:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,0.3molFe粉与足量水蒸气反应,生成0.4molH2,生成的H2分子数为0.4NA,故B错误;
C.K原子最外层一个电子与足量氧气反应电子转移1mol,1mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA ,故C正确;
D.室温下1 LpH=13的NaOH溶液中氢离子浓度为1×10-13mol/L,由于氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,所以由水电离的OH-离子的浓度与溶液中氢离子浓度相同,由水电离的OH-数目为10-13NA,故D正确;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,主要是物质微粒计算、溶液中离子浓度大小计算、氧化还原反应电子转移总数计算等知识来解答,为易错题,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “天宫”一号中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 氢氧化铁溶胶、雾、食盐水均能观察到丁达尔效应 | |
| C. | 盐酸、氢氧化铁胶体、汽油、橡胶均为混合物 | |
| D. | 生成盐和水的反应不一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| B. | 将草木灰和硫酸铵混合施用,肥效更高 | |
| C. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 | |
| D. | 硫酸工业尾气未经处理就直接排放,将直接导致“温室效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计了有关氯气的实验:
某同学设计了有关氯气的实验:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
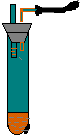 如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a中盛浓盐酸,b中盛浓硫酸 | B. | a中盛浓硫酸,b中盛固体氯化铵 | ||
| C. | f中盛固体氯化钠和浓硫酸 | D. | f中盛固体氯化铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

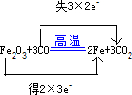 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com