
科目:高中化学 来源: 题型:
下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH—Ni电池)。下列有关说法不正确的是( )
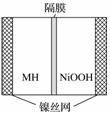
A.放电时正极反应为NiOOH+H2O+e-—→Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为MH+OH-—→H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
溴酸银(AgBrO3)溶解度随温度变化曲线如下图所示。下列说法错误的是( )

A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于10-5mol·L-1时,沉淀就达完全。下列叙述正确的是( )
A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C.向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO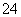 完全沉淀
完全沉淀
D.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3) X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种,)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为+6价Cr。制三氯化铬的流程如下:
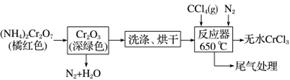
(1)重铬酸铵分解产生三氧化二铬(Cr2O3),其分解的化学方程式为________________________________________________________________________。
(2)已知CCl4沸点为57.6 ℃,为保证稳定的CCl4气流,适宜的加热方式是______________。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序:⑥→③→________________,步骤②中通入氮气的目的是________________________________________________________________________。
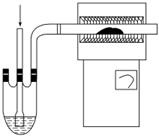
(4)已知反应管中发生的主要反应有Cr2O3+3CCl4—→2CrCl3+3COCl2,因光气有剧毒,故实验需在通风橱中进行,并用浓氨水处理COCl2,生成两种常见的氮肥,它们分别是__________________(写名称)。
(5)样品中三氯化铬质量分数的测定:
称取样品0.330 0 g,加水溶解并配成250 mL溶液。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol·L-1 H2SO4至溶液呈强酸性,此时铬以Cr2O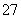 存在,再加入过量KI,塞上塞子,摇匀,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1硫代硫酸钠标准溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。
存在,再加入过量KI,塞上塞子,摇匀,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1硫代硫酸钠标准溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。
已知:Cr2O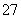 +6I-+14H+===2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
+6I-+14H+===2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为______________。
②本实验除移液管、碘量瓶、烧杯外,还需要的玻璃仪器有______________。
③样品中无水三氯化铬的质量分数为________(计算结果精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
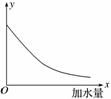
A.溶液中OH-的物质的量浓度
B.溶液的导电能力
C.溶液中的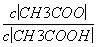
D.CH3COOH的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com