
- 4 |
| 6.945g-0.04mol×142g/mol-0.02mol×34g/mol |
| 58.5g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、从开始反应到达平衡,所需时间tA>tB |
| B、平衡时,I2蒸气在混合气体中的体积分数φA>φB |
| C、平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B |
| D、HI的平衡转化率,αA=αB |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
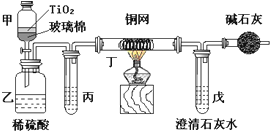 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
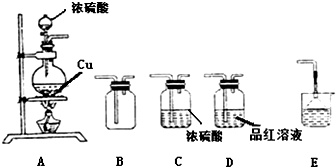
查看答案和解析>>
科目:高中化学 来源: 题型:

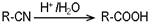 .请回答下列问题:
.请回答下列问题: ),请设计合成路线(无机试剂及溶剂任选).
),请设计合成路线(无机试剂及溶剂任选).| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com