
| A. |  | B. |  | C. |  | D. |  |
分析 首先发生中和反应,没有沉淀产生,然后AlO2-+H++H2O=Al(OH)3↓,产生Al(OH)3沉淀,最后Al(OH)3 +3H+=Al3++3H2O,沉淀溶解,注意沉淀产生、沉淀溶解消耗的H+个数比是1:3.
解答 解:首先发生中和反应,没有沉淀产生,然后AlO2-+H++H2O=Al(OH)3↓,产生Al(OH)3沉淀,最后Al(OH)3 +3H+=Al3++3H2O,沉淀溶解,注意沉淀产生、沉淀溶解消耗的H+个数比是1:3;
A、开始无沉淀生成,图象不符合,故A错误;
B、依据分析可知,开始是中和反应,无沉淀生成,故B错误;
C、开始无沉淀生成,随后生成沉淀达到最大后沉淀溶解,但沉淀产生、沉淀溶解消耗的H+个数比是1:3,离子定量关系不符合,故C错误;
D、开始无沉淀生成,随后生成沉淀达到最大后沉淀溶解,沉淀产生、沉淀溶解消耗的H+个数比是1:3,离子定量关系符合,故D正确;
故选D.
点评 本题考查了铝及其化合物性质的分析判断,主要是图象曲线的变化,沉淀生成和溶解的定量关系分析,掌握反应实质和反应现象是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO2和O3含有的氧原子数均为3NA | |
| B. | 常温常压下,11.2L乙烯含有2NA个碳原子 | |
| C. | 1.7g氨气所含有的电子数目为10NA | |
| D. | 2.7g铝与足量NaOH反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要使用托盘天平称量Na2CO3•10H2O晶体2.86g | |
| B. | 将称量好的Na2CO3•10H2O晶体放入烧杯中,加入100mL蒸馏水,搅拌、溶解 | |
| C. | 转移溶液时应使用玻璃棒引流,且玻璃棒末端应靠在容量瓶刻度线下方 | |
| D. | 定容时,俯视刻度线会使所配制溶液的物质的量浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径B>A>C | B. | 原子序数A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
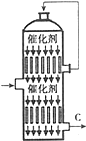 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com