
下列离子方程式中正确的是 ( )
A.工业上粗硅的制备:SiO2+C Si+CO2↑
Si+CO2↑
B.Cu2O与稀H2SO4反应:Cu2O+2H+=2Cu++H2O
C.用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-=3Ag++NO↑+2H2O
D .向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32-
.向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32-
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入明矾可以起到净水作用 | |
| B. | 热糖水降低温度后有固体析出,则原热糖水一定是饱和溶液 | |
| C. | 配制溶液时搅拌可以增大溶质的溶解度 | |
| D. | 物质溶于水时不会放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
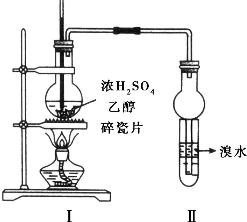 实验室制取乙烯的装置如图所示,试回答:
实验室制取乙烯的装置如图所示,试回答:查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
卤素互化物(XX’n)的性质与卤素单质相似,其中非金属性: X<X’。已知反应如下:3H2O + 2ICl3 = 5HCl + ICl + HIO3。则下列判断正确的是:( )
A.XX’n 属于活泼非金属单质
B.ICl3 属于共价化合物
C.上述反应中HCl是还原产物
D.ICl溶于水的反应:ICl + H2 O = HIO + HCl 不属于氧化还原反应
O = HIO + HCl 不属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
按照冶金工业的分类,下列合金属于黑色金属材料的是( )
A.锰钢 B.青铜 C.铝锂合金 D.镧镍储氢合金
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量 存在的离子是Na+、OH–
存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的 溶液均显中性
溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com