
| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
分析 根据v=$\frac{△c}{△t}$计算v(NO),再根据速率之比等于化学计量数之比计算用其它物质表示的反应速率.
解答 解:在5L的密闭容器中进行30s后,NO的物质的量增加了0.3mol,则v(NO)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L•min).
A、速率之比等于化学计量数之比,所以v(O2)=$\frac{5}{4}$v(NO)=$\frac{5}{4}$×0.002mol/(L•min)=0.0025mol/(L•min),故A错误;
B、v(NO)=0.002mol/(L•min),故B错误;
C、速率之比等于化学计量数之比,所以v(H2O)=$\frac{3}{2}$v(NO)=$\frac{3}{2}$×0.002mol/(L•min)=0.003mol/(L•min),故C错误;
D、速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L•min),故D正确.
故选D.
点评 本题考查化学反应速率的计算,比较基础,反应速率计算通常有定义法、化学计量数法,根据情况选择合适的方法.


科目:高中化学 来源: 题型:解答题
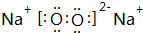 ,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二种 | B. | 三种 | C. | 四种 | D. | 五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷一种无色无味的气体 | B. | 甲烷性质稳定,不和其它物质反应 | ||
| C. | 甲烷极难溶解于水 | D. | 甲烷密度比空气的密度小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下能发生加聚反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 该有机物能发生加成反应但不能发生催化氧化生成醛 | |
| D. | 1mol该有机物能与足量的金属钠反应放出0.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
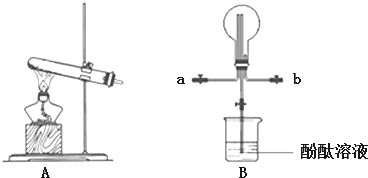
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com