
| A. | 含氧酸的酸性:X对应的强于Y对应的 | |
| B. | 气态氢化物的稳定性:HmX强于HnY | |
| C. | 第一电离能可能Y大于X | |
| D. | X与Y形成化合物时,X显负价,Y显正价 |
分析 同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y.
A.非金属性越强,最高价含氧酸的酸性越强,不是最高价含氧酸则不一定;
B.非金属性越强,氢化物越稳定;
C.若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能;
D.电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大.
解答 解:同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y.
A.非金属性越强,最高价含氧酸的酸性越强,不是最高价含氧酸则不一定,若非金属性Cl>S,但HClO为弱酸,而硫酸为强酸,故A错误;
B.非金属性越强,最高价含氧酸的酸性越强,同周期自左而右元素的非金属性增强,故非金属性X>Y,所以氢化物的稳定性:HmX强于HnY,故B正确;
C.若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能,如第一电离能P>S,故C正确;
D、电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大,电负性X>Y,键合电子偏向X原子,偏离Y原子,故X与Y形成化合物中,X显负价,Y显正价,故D正确;
故选B.
点评 本题考查同周期元素性质递变规律、电离能、电负性等,难度不大,注意同周期元素中第一电离能异常情况.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 它的名称为( )
它的名称为( )| A. | 3,3-二甲基-2-乙基-戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,3,3-三甲基戊烷 | D. | 3,3,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
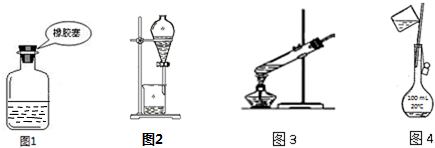
| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至多有26个原子处于同一平面上 | |
| C. | 该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com