
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材 料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li +2H2O===2LiOH+H2↑
科目:高中化学 来源: 题型:
请回答下列问题:
(1)31Ga基态原子的核外电子排布式是________________。某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是________,其晶体结构类型可能为________。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
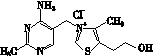
以下关于维生素B1的说法正确的是________。
A.只含σ键和π键
B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl
D.该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________。
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
环保部制定的《环境空气质量标准》第二次公开征求意见结束,大家普遍赞成将PM2.5(PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物)纳入常规空气质量评价,下列有关PM2.5说法不正确的是
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成气溶胶
C.实施绿化工程,可以有效地防治PM2.5污染
D.研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢的沸点比水高,但受热容易分解。某试剂厂先制得7~8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是( )
A.常压蒸馏 B.减压蒸馏
C.加生石灰常压蒸馏 D.加压蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。下列有关叙述正确的是( )
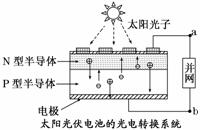
A.光伏电池是将太阳能转变为电能
B.光伏电池是将化学能转变为电能
C.电流从a流向b
D.图中N型半导体为正极,P型半导体为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2 (s)+Mn2O3(s),下列说法错误的是( )
(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极反应为2MnO2(s)+H2O(l)+2e-―→Mn2O3(s)+2OH-(aq)
C.电池工作时,负极附近溶液碱性增强
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反 应方程式:__________________________________________________。
应方程式:__________________________________________________。
 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为________________________________,正极的反应式为________________。理想状态下,该燃料电池消耗1 mol 甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:(1)Na3N的电子式是__________;该化合物是由__________键形成的__________(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com