
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期数与主族序数相等。
请回答下列问题:
![]()
(1)W在周期表中的位置是___________________________________,Q、R、T三种元素原子半径由大到小的顺序为________________________________。(用元素符号表示),
(2)QO2的电子式为_______________,R的最高价氧化物的化学式___________。
(3)T单质与NaOH 溶液反应的离子方程式为______________________
(4)T单质与W最高价氧化物的水化物溶液反应的离子方程式为_______________________
【答案】第3周期、第ⅥA族 Al>C>N ![]() N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Al+6H+=2Al3++3H2↑
N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Al+6H+=2Al3++3H2↑
【解析】
根据元素在元素周期表中的位置分析元素的种类;根据元素周期律分析解答;根据物质组成和性质书写电子式,及相关反应的离子方程式。
T所处的周期数与主族序数相等,则T为第3周期的IIIA族,为铝元素;根据Q、R、T、W在元素周期表中的位置关系知,Q为碳,R为氮,W为S;
(1)W为硫元素,原子序数为16,则在周期表中的位置是第3周期、第ⅥA族;同周期元素从左到右原子半径减小,同主族元素从上到下原子半径增大,则Q、R、T三种元素原子半径由大到小的顺序为Al>C>N;
(2)QO2为CO2,其电子式为![]() ;R的最高价为+5,其氧化物的化学式为N2O5 ;
;R的最高价为+5,其氧化物的化学式为N2O5 ;
(3)T单质为Al,与NaOH 溶液反应的离子方程式为:2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)W的最高价氧化物的水化物为硫酸,则铝和硫酸反应的离子方程式为:2Al+6H+=2Al3++3H2↑。


科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________。
(2)步骤Ⅱ吸收Br2,有关反应的化学方程式为___________________________,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_________________。
(3)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M层的电子数之和。
(1)A为________________(填元素名称,下同), C为___________;
(2)写出E的电子式_______________。
(3)A、B的一种化合物与E反应的化学方程式为_______________________;
(4)A、B两种元素形成的化合物属于____________(填“离子”或“共价”)化合物;
(5)D的最高价氧化物对应的水化物的浓溶液和A的单质反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、NOx等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1)已知:2C(s)+O2(g)![]() 2CO(g) ΔH1= -221.0 kJ/mol
2CO(g) ΔH1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) ΔH2= +180.5 kJ/mol
2NO (g) ΔH2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
用焦炭还原NO生成无污染气体的热化学方程式为_________________________________。
(2)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
(3)CO2可用来生产燃料甲醇。CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
②氢气的转化率=________________________。
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入0.5 mol CO2 和1.5 mol H2
C.充入He(g),使体系压强增大 D.将H2O(g)从体系中分离出去
(4)利用如图所示电解装置(电极均为惰性电极)可吸收SO2,并用阴极室排出的溶液吸收NO2 。与电源b极连接的电极的电极反应式为____________________________________。
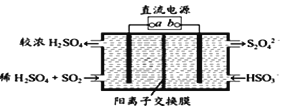
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):

(1)反应①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”)。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
(3)加入醋酸溶液,调节溶液的pH < 5时,发生的反应是___________(写离子方程式).
(4)下表是相关物质的溶解度数据:
物质 | 溶解度( g / 100 g H2O ) | ||
0 ℃ | 40 ℃ | 80 ℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①调节pH < 5后,加入KCl固体经一系列操作析出K2Cr2O7晶体的理由是______________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的CrO5,该反应可用来检验Cr2O72的存在。已知该反应是非氧化还原反应,写出反应的离子方程式:________________,CrO5分子结构中过氧键的数目是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA
B. 密闭容器中2mol NO与1mol O2充分反应,产物的分子数为2NA
C. 24g二氧化硅晶体中含有SiO2分子数为0.4 NA
D. 5.6gFe与含0.2molHNO3的溶液充分反应,至少失去电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色透明的酸性溶液中,可能大量含有的离子组是
A.Na+、NH4+、NO3-、SiO32-B.Na+、Cu2+、SO42-、Cl-
C.Mg2+、Al3+、Cl-、NO3-D.K+、Ag+、HCO3-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:

(1)①该反应的化学方程式是_______________________________。
②在t1 min时,该反应达到了____状态,下列可作为判断反应已达到该状态的是____。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2∶3
C.生成3 mol Y的同时生成1 mol Z D.生成1 mol Z的同时生成2 mol X
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为____:在此t1 min时间内,用H2表示反应的平均速率v(H2)为_________。
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为说法中正确的是____同学。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com