
| A. | 单位时间内消耗amol H2,同时消耗 2amol HI | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器内H2、I2不再减少,HI不再增加 | |
| D. | 单位时间内每生成amol HI,同时a NA个HI分子分解 |
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,注意该反应是反应前后气体体积不变的化学反应,压强对该反应无影响,据此进行判断.
解答 解:A、单位时间内消耗amolH2同时生成2amolHI,且同时又消耗2amolHI,所以碘化氢的正逆反应速率相等,达到平衡状态,故A不选;
B、该反应是反应前后气体体积不变的化学反应,所以无论反应是否达到平衡状态混合气体的压强始终恒定不变,故B选;
C、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,所以容器内H2、I2不再减少,HI不再增加,该反应达到平衡状态,故C不选;
D、单位时间内每生成amolHI,同时aNA个HI分子分解,反应方向相反且速率相等,达到平衡状态,故D不选;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意压强对反应前后气体体积不变的化学平衡无影响,只影响其反应速率.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
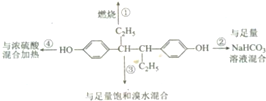 己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )
己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )| A. | ①中生成7molH2O | B. | ②中无CO2生成 | ||
| C. | ③中最多消耗3molBr2 | D. | ④中发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
| C | KNO3和KOH混合溶液中加入铝粉 并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加 Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ④③ | C. | ⑤③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl和NaCl的固体混合物可用升华法分离 | |
| B. | 所有铵盐都易溶于水,所有铵盐中的氮均呈-3价 | |
| C. | 硝铵中不含铵根离子 | |
| D. | 铵态氮肥不能与碱性物质如草木灰混合施用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
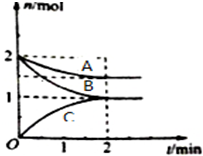 一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
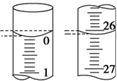 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3分子是由极性键构成的极性分子 | |
| B. | NCl3分子的空间构型为三角锥形 | |
| C. | NCl3中的所有原子均达到8电子稳定结构 | |
| D. | NF3的沸点比NCl3的沸点低是因为N-F比N-Cl键键能小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com