
 I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题: I3-的平衡常数K=__________(用具体数据列出计算式即可)。
I3-的平衡常数K=__________(用具体数据列出计算式即可)。 科目:高中化学 来源: 题型:阅读理解
| c[I2(CCl4)] |
| c[I2(H2O)] |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
查看答案和解析>>
科目:高中化学 来源:2010年江苏省栟茶高中高三模拟考试化学试卷 题型:实验题
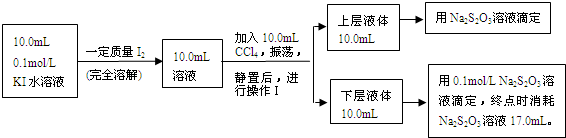
(12分)测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I- I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用_________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是__________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即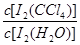 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是______(填名称)。
试指出该操作中应注意的事项为 。(任写一条)
(4)下层液体中碘单质的物质的量浓度是__________。
(5)实验测得上层溶液中c(I3-)="0.049" mol·L-1,结合上述有关数据,计算室温条件下反应I2+I- I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I-![]() I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用_________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是__________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
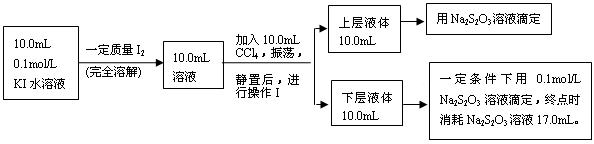
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即![]() 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是______(填名称)。
试指出该操作中应注意的事项为 。(任写一条)
(4)下层液体中碘单质的物质的量浓度是__________。
(5)实验测得上层溶液中c(I3-)=0.049 mol·L-1,结合上述有关数据,计算室温条件下反应I2+I-![]() I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
测定平衡常数
对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I-![]() I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用___________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是____________(填字母)。
A.方案可行。能准确测定溶液中的c(I2) B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
 Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即![]() 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。
回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是________(填名称)。
试指出该操作中应注意的事项为 。(任写一条)
(4)下层液体中碘单质的物质的量浓度是________________。
(5)实验测得上层溶液中c(I3-)=0.049 mol·L-1,结合上述有关数据,计算室温条件下反应I2+I-![]() I3-的平衡常数K=____________________(用具体数据列出计算式即可)。)
I3-的平衡常数K=____________________(用具体数据列出计算式即可)。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com