
【题目】(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
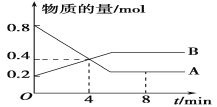
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ,A的反应速率为_____ ,A的转化率为_____。
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
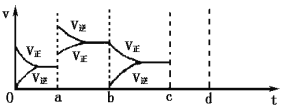
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g)![]() 2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
【答案】2A![]() B0.025mol/(Lmin)0.05mol/(Lmin)50%否=升温减小SO3的浓度
B0.025mol/(Lmin)0.05mol/(Lmin)50%否=升温减小SO3的浓度
【解析】
(1)①根据图象可知A为反应物,B为生成物,反应进行到4min时A物质的量变化为0.8mol-0.4mol=0.4mol,B物质的量变化0.4mol-0.2mol=0.2mol,A、B反应的物质的量之比2:1,所以反应的化学方程式为2A![]() B;
B;
②反应开始至4min时,A物质的量变化为0.4mol,浓度是0.4mol÷2L=0.2mol/L,则A的平均反应速率为0.2mol/L÷4min=0.05mol/(Lmin),反应速率之比是化学计量数之比,则B物质表示的反应速率是0.025mol/(Lmin)。A的转化率为![]() 。;
。;
③根据图像可知4 min时随时间变化A、B物质的量发生变化,说明未达到平衡,8 min时A、B物质的量不变,说明反应达到平衡状态,因此v(正)=v(逆);
(2)a时逆反应速率大于正反应速率,说明平衡应向逆反应方向移动,且正逆反应速率都增大,该反应的正反应放热,应为升高温度的结果;b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,即b时改变的条件可能是减小SO3的浓度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
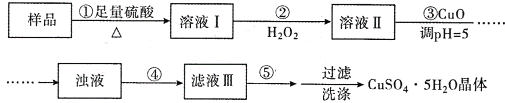
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(俗名)、化学式都正确的是( )
A.碱性氧化物 氧化铁 FeO
B.酸性氧化物 碳酸气 CO2
C.酸 硫酸 H2SO3
D.盐 纯碱 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LCHCl3 中含有氯原子数目为 3NA
B. 18g D2O 和 18g H2O 中含有的质子数均为 10NA
C. 4.6gNa 与 O2反应生成 Na2O 和 Na2O2 混合物时失去的电子数为 0.2NA
D. 25℃时 pH=13 的 Ca(OH)2溶液中含有 OH-的数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 是原子序数依次增大的四种短周期元素。W 的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,W、X、Y、Z 的最外层电子数之和为 16。回答下列问题:
(1)Z 单质的电子式是 ________________。W 的气态氢化物能使紫色石蕊溶液变蓝的原因:__________________(用化学方程式表示)。
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是:_____。
(3)Z 最高价氧化物对应的水化物化学式为 ____。
(4)Z 和氧元素、硫元素组成的 SOZ2 是一种液态化合物,沸点为 77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出, 该气体可使滴有品红试液的滤纸褪色。请写出 SOZ2 和水反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应S(s)+O2(g)![]() SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
(1)升温_____;
(2)增大压强_____;
(3)增大容器容积____;
(4)加入O2____;
(5)加入S_____;
(6)加正催化剂_____。
(7)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______。
A.消耗1molO2同时生成1molSO2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.v正(O2)=v逆(SO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖3.42 g与淀粉3.24 g混合并完全水解,若生成mg葡萄糖和ng果糖,则m:n为
A. 1:3 B. 1:5 C. 5:1 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. S(s)+3/2O2(g)=SO3(g) △H=-315kJ·mol-1(燃烧热)(△H的数值正确)
B. 氢气的燃烧热为285.5kJmol-1,则2H2O(l)=2H2(g)+O2(g) △H=+285.5kJmol-1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1;将3 mol H2和过量的N2在此条件下充分反应,放出的热量小于92.4kJ
2NH3(g) △H=-92.4kJmol-1;将3 mol H2和过量的N2在此条件下充分反应,放出的热量小于92.4kJ
D. 已知HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq) △H=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。

则:①写出下列物质的化学式:
丙__________,B____________,C__________, D____________。
②写出甲跟乙反应的化学方程式:__________________________。
③单质丙与溶液乙反应生成气体B的离子方程式:___________________。
(2)如图是各物质的反应关系图:已知A和E都是黄色粉末,F有刺激性气味且有漂白性。请据此回答下列问题:

写出图中编号的化学方程式:
①_______________________;
②_______________________;
③______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com