
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.分析 (1)C60分子含有30个共价键,发生加成反应时一个C60分子中含有的碳碳双键个数和氟气分子个数相同,1molC60分子中30mol碳碳双键,所以需要30mol氟气,根据原子守恒写出加成产物的化学式;
(2)水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,而受热融化时氢键被破,干冰分子之间只存在范德华力,形成的分子晶体是密堆积;
(3)a、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构;
bc、sp2杂化中,s轨道的成分比sp3杂化更多,而且石墨的碳原子还有大π键所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量;
d、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构;
e、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,晶体中只含有共价键;石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键.因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质,石墨为层状结构,层与层之间通过范德华力连接;
f、石墨为层状结构,层与层之间通过范德华力连接;
(4)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,根据金刚石的结构判断,在BN晶体中,每个B原子和4个N原子形成共价键,所以B原子周围最近的N原子所构成的立体图形为正四面体;B原子的配位数是4,B原子与N原子之间共价键的数目是12,一个晶胞中N原子数目为4;
(5)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;金属铜采用面心立方最密堆积;以晶胞顶点上的铜原子为例,与之距离最近的铜原子分布在经过该原子的12个面的面心上,距离为面对角线的一半,所以铜原子的配位数为12;晶胞内Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,令铜原子的比较为rcm,则晶胞的棱长为 $\frac{\sqrt{2}}{2}$×4rcm=2$\sqrt{2}$rcm,所以(2$\sqrt{2}$r)3×ρ=$\frac{4M}{{N}_{A}}$,据此计算铜原子半径.
解答 解:(1)C60分子含有30个共价键,发生加成反应时一个C60分子中含有的碳碳双键个数和氟气分子个数相同,1molC60分子中30mol碳碳双键,所以需要30mol氟气,所以其加成产物的化学式为:C60F60;
故答案为:C60F60;
(2)a、水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,密度比水小,干冰分子之间只存在范德华力,形成的分子晶体是密堆积,密度比水大,故a正确;
b、冰融化时氢键被破,干冰分子之间只存在范德华力,融化时破坏范德华力,氢键比范德华力强,故晶体的熔点冰>干冰,故b错误;
c、水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,干冰分子之间只存在范德华力,形成的分子晶体是密堆积,晶体中的空间利用率:干冰>冰,故c正确;
d、干冰分子之间存在范德华力,水分子间存在氢键,晶体中分子间相互作用力类型不相同,故d错误.
故选:ac;
(3)a、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,碳原子的杂化类型为sp3杂化;石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp2杂化,故a正确;
b、sp2杂化中,s轨道的成分比sp3杂化更多,而且石墨的碳原子还有大π键所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的键长短,故b错误;
c、石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量,所以晶体的熔点金刚石<石墨,故c错误;
d、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,键角为109°28′,石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,键角为120°,故d错误;
e、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键.因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质,石墨为层状结构,层与层之间通过范德华力连接,说明晶体中含有共价键、金属键、范德华力,故e正确;
f、金刚石是原子晶体,石墨为层状结构,层与层之间通过范德华力连接,石墨为混合型晶体,不属于原子晶体,故f错误;
故选:ae;
(4)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,在BN晶体中,每个B原子和4个N原子形成共价键,所以B原子周围最近的N原子所构成的立体图形为正四面体;B原子的配位数是4,B原子与N原子之间共价键的数目是12,所以B原子与N原子之间共价键的数目与配位键的数目比为 3:1,一个晶胞中N原子数目为 4,
故答案为:正四面体;3:1;4;
(5)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;金属铜采用面心立方最密堆积;以晶胞顶点上的铜原子为例,与之距离最近的铜原子分布在经过该原子的12个面的面心上,距离为面对角线的一半,所以铜原子的配位数为12;Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,令铜原子的比较为rcm,则晶胞的棱长为 $\frac{\sqrt{2}}{2}$×4rcm=2$\sqrt{2}$rcm,所以(2$\sqrt{2}$r)3×ρ=$\frac{4M}{{N}_{A}}$,r=$\frac{\sqrt{2}}{4}$×$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm,
故答案为:1s22s22p63s23p63d104s1;面心立方最密;12;$\frac{{\sqrt{2}}}{4}×\root{3}{{\frac{4M}{{ρ{N_A}}}}}$cm.
点评 本题考查晶体类型与熔沸点高低判断、晶体结构、对晶胞的理解与计算等,难度较大,对晶胞的计算注意均摊法的利用,需要学生具备空间想象能力,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| 选项 | 化学事实 | 类推结论 |
| A | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧也生成Fe2O3 |
| B | 用分别蘸取了浓盐酸和浓氨水的两根玻璃棒相互靠近不接触,可看到白烟 | 用分别蘸取了浓硫酸和浓氨水的两根玻璃棒相互靠近不接触,可以看到白烟 |
| C | 电解熔融MgCl2的方法冶炼金属镁 | 电解熔融NaCl的方法制取金属钠 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2 与浓盐酸反应制 Cl2:MnO2+4HCl═Mn2++2Cl-+CI2↑+2H2O | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | Ca(HCO3)2 溶液与少量 NaOH 溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 明矾溶于水产生 Al(OH)3胶体:Al3++3H2O═Al(OH)↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在实验室中用浓盐酸与MnO2共热制取Cl2.
在实验室中用浓盐酸与MnO2共热制取Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.4mol AgNO3受热完全分解(2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.2NA | |
| B. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| C. | 1 mol FeI2与一定量氯气反应时,若已知有1mol Fe2+被氧化则转移的电子数为3NA | |
| D. | 1mol 苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲中正极的电极反应式:2H++2eˉ=H2↑ | |
| C. | 装置乙中电流从铜片经导线流向锌片 | |
| D. | 装置乙溶液中SO42ˉ向铜片做定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )| A. | 该物质可以视为酚类 | |
| B. | 在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体 | |
| C. | 能使溴的四氯化碳溶液褪色 | |
| D. | 该物质分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
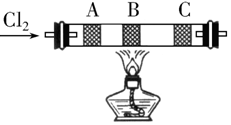 在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.
在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com