
| A. | 氢氧化钡溶液与稀硫酸反应 SO42-+Ba2+═BaSO4↓ | |
| B. | 氢氧化钠溶液与稀硫酸反应 OH-+H+═H2O | |
| C. | 铁与氯化铁溶液反应 Fe+Fe3+═2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中 CO32-+2H+═H2O+CO2↑ |
分析 A.漏写生成水的离子反应;
B.反应生成硫酸钠和水;
C.电子、电荷不守恒;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.氢氧化钡溶液与稀硫酸反应的离子反应为2OH-+2H++SO42-+Ba2+═BaSO4↓+2H2O,故A错误;
B.氢氧化钠溶液与稀硫酸反应的离子反应为OH-+H+═H2O,故B正确;
C.铁与氯化铁溶液反应的离子反应为Fe+2Fe3+═3Fe2+,故C错误;
D.碳酸钙溶于稀盐酸中的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故D错误;
故选B.
点评 本题考查离子反应方程式的书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硝酸反应 Fe+2H+═Fe2++H2↑ | |
| B. | 氯化铁溶液滴入沸水 Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 硝酸银溶液中滴入食盐水 NaCl+Ag+═AgCl↓+Na+ | |
| D. | 氯气通入烧碱溶液 Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 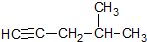 :4-甲基-1-戊炔 :4-甲基-1-戊炔 | B. | CH3CH(CH3)CH=CHCH3:2-甲基-3-戊烯 | ||
| C. | 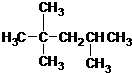 :2,2,4-三甲基戊烷 :2,2,4-三甲基戊烷 | D. |  :间二硝基苯 :间二硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸溶液中:K+、Fe2+、MnO4-、SO42- | |
| B. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- | |
| C. | 既能溶解Al(OH)3又能溶解 H2SiO3的溶液中:Na +、CO32-、SO32-、NO3- | |
| D. | 在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

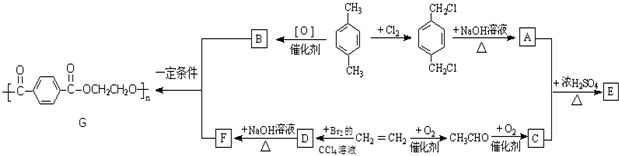
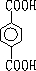
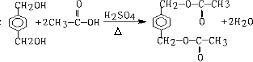
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
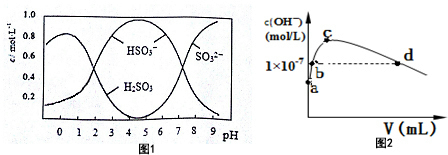 (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-14 | Ki=4.9×10-14 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温pH=3的硫酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 | |
| B. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒能凝聚水中的悬浮物 | |
| C. | 除去MgCl2溶液中的FeCl3,可向其中加入MgCO3 | |
| D. | 除去锅炉水垢中的CaSO4,可加入Na2CO3溶液将其转化为CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com