
下列实验装置或操作能达到实验目的的是
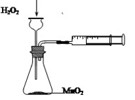
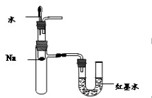
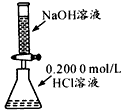
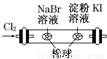
A B C D
A.定量测定反应速率 B.验证Na和水反应的热效应
C.酸碱中和滴定 D.证明氧化性Cl2>Br2>I2
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(如图)就能实现相应实验目的是( )
选项 | A | B | C | D |
实验目的 | 从碘水中提取碘 | 用10mol?L-1盐酸配制100mL 0.1mol?L-1盐酸 | 用NaCl溶液制备氯化钠晶体 | 除去C2H4中少量SO2 |
实验仪器或装置 | 烧杯、分液漏斗 | 100mL容量瓶、量筒、玻璃棒、烧杯 |
|
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.“雨后彩虹”是一种自然现象,与胶体的知识有关
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.“通风橱”是一种负责任的防污染手段,可使有害气体得到转化或吸收
D.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的C02反应使瓶内气体减少形成“负压”之故
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
利用下图装置进行实验,甲乙两池均为l mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是

A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,A电极发生氧化反应
D.断开K1,闭合K2后,NO3-向B电极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:填空题
化学反应原理对于工业生产和科研有重要意义
I、下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) | K3 | ? | ? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 _____(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
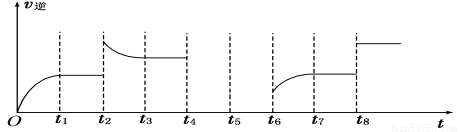
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________; t8时__________________。
②若t4时降压, t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
II、(5)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为 。
(6)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液。
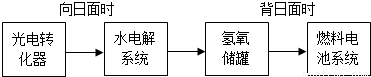
如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E;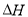 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;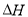 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;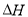 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);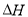 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率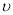 ( A2)为 。
( A2)为 。
②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
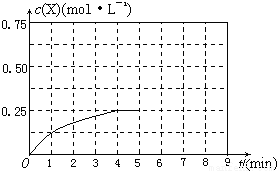
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
用下图所示装置进行实验,不能达到实验目的的是:( )

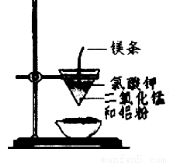
甲 乙
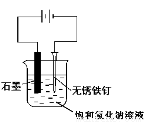

丙 丁
A.用甲装置比较硫、碳、硅三种元素的非金属性强弱
B.用乙装置可制得金属锰,用同样的装置可制得金属铬
C.用丙装置可实现对铁钉的保护
D.用丁装置验证铜与稀硝酸反应的气体产物只有NO
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:填空题
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
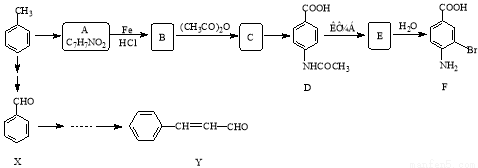
已知:ⅰ) 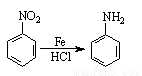 ;ⅱ)
;ⅱ)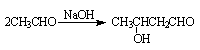 。
。
请回答下列问题:
(1)写出Y中含氧官能团的名称 ;
(2)下列有关F的说法正确的是 ;
A.分子式是C7H7NO2Br B.既能与盐酸反应又能与NaOH溶液反应
C.能发生酯化反应 D.1 mol F最多可以消耗2 mol NaOH
(3)写出由甲苯→A反应的化学方程式 ;
(4)在合成F的过程中,B→C步骤不能省略,理由是 ,
F在一定条件下形成的高分子化合物的结构简式是 ;
(5)写出一种同时符合下列条件的Y的同分异构体的结构简式 ;
①苯环上只有两种不同化学环境的氢原子 ②与足量浓溴水反应产生白色沉淀
③分子中只存在一个环状结构
(6)以X和乙烯为原料可合成Y,请写出你设计的合成路线(无机试剂及溶剂任选)。
合成路线的书写格式如下:
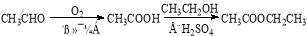
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com