
| A.汤姆生 | B.卢瑟福 | C.道尔顿 | D.波尔 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.三者原子半径大小顺序为X>Y>Z |
| B.分子组成为Y5Z12的物质一定为纯净物 |
| C.1.5molX2与2molY恰好完全反应时,可得到相同物质的量的两种氧化物 |
| D.实验室用Z2X2为原料可以制备X2,每转移2mol电子,得到22.4LX2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
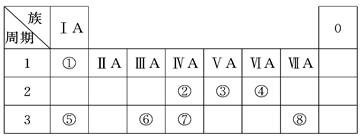
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 | | |
| 2 | | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.元素X和Y可以形成两种以上的气态化合物 |
| B.原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C.元素的最高价氧化物对应水化物的酸性R强于M |
| D.加热蒸干由元素B和Z形成的化合物的水溶液可以得到该化合物的晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。 。(填序号)
。(填序号)| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4> KBrO3 KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |

 物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
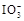 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在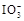 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1s2与2s2的元素 |
| B.M层上有2个电子与N层上有2个电子的元素 |
| C.2P上有一个未成对电子与3P上有一个未成对电子的元素 |
| D.L层上有一个空轨道和M层的P轨道上有一个空轨道的元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 电子式为 ;反应③中被破坏的化学键属
电子式为 ;反应③中被破坏的化学键属 于 键(填“极性”或“非极性”)。
于 键(填“极性”或“非极性”)。 位于周期表的第
位于周期表的第  周期 族。
周期 族。 3)卤素单质及化
3)卤素单质及化 合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
合物在许多性质上都存在着递变规律。下列有关说法正确的是 。 氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
氢的还原性按HF、HCl、HBr、HI的顺序依次减弱查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气态氢化物的稳定性:X>Y>Q |
| B.X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同 |
| C.Q的单质不存在同素异形体 |
| D.相同质量的Z和W单质分别与足量稀盐酸反应时,Z的单质获得的氢气多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com