
【题目】某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3,其中FeSO4为反应物.则该反应中的还原产物为
A.Fe(NO3)3 B. HNO3 C. Fe2(SO4)3 D.NO
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法中不正确的是
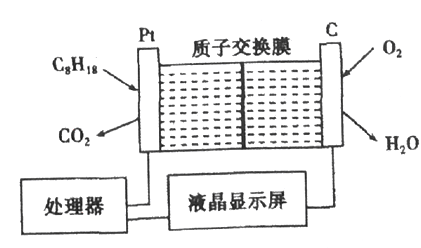
A. 石墨电极作正极,发生还原反应
B. 铂电极的电极反应式为:C8H18+16H2O-50e-=8CO2+50H+
C. H+由质子交换膜左侧向右侧迁移
D. 每消耗标准状况下5.6 L O2溶液中通过lmol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是()
A. Cl2+H2O=HCl+HClO B. NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
C. 5NH4NO3![]() 2HNO3+ 4N2↑ + 9H2O D. SO2+2H2S=2H2O+3S
2HNO3+ 4N2↑ + 9H2O D. SO2+2H2S=2H2O+3S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置。
Ⅰ.浓硝酸的强氧化性实验
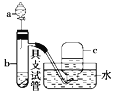
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:___________________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象_________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是________________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是____________________(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是________________________________________________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶滚中加入金属铝有氢气放出,则在此溶液中一定能大量共存的离子是
A. K+、Na+、Cl-、HCO3- B.K+、NH4+、Cl-、CO32-
C. K+、Fe2+、NO3-、SO42- D. K+、Na+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙炔气体中常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,选择最简便的实验方案有( )
A.通过NaOH后,通过浓H2SO4,再通过石灰水
B.通过CuSO4溶液后再通过石灰水
C.通过五氧化磷,再通过无水CaCl2
D.通过足量的碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢分子中含有过氧键(﹣O﹣O﹣).有机化合物A的相对分子质量为120.经分析,其中氧的质量分数为0.5334,其余为碳和氢,则A分子中过氧键数最多为( )
A.1
B.2
C.3
D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物H是药物常山酮的合成中间体,合成H的流程图如下:
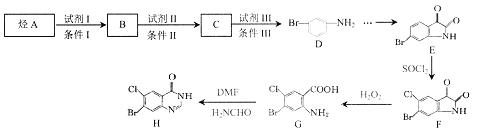
已知:① 苯环上原有取代基对新导入苯环上的取代基位置有一定影响,其规律如下:
-OH、-CH3、-Br等取代基使新导入的取代基主要进入原取代基邻位和对位;
-NO2、-SO3H、-CHO等取代基使新导入的取代基主要进入原取代基间位。
②![]() (-NH2易被氧化)
(-NH2易被氧化)
③ 甲苯可被酸性高锰酸钾氧化为苯甲酸
回答下列问题:
(1)D中的官能团名称为_________。
(2)E→F的反应类型为__________。
(3)B→C的化学反应方程式为___________。
(4)G在一定条件下能发生缩聚反应,该反应方程式为__________。
(5)W与B是同系物,W与B的最大质荷比相差14,同时满足下列条件的W的同分异构体有_______种。
① 能与NaOH溶液反应 ② 苯环上有两个取代基 ③ 遇氯化铁溶液不显色
其中核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:2的所有物质的结构简式是______。
(6)写出以甲苯为原料合成![]() 的流程图(无机试剂任用)_______
的流程图(无机试剂任用)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的锰矿石和锌矿石产地在云南、广东、青海等。软锰矿是一种常见的锰矿石,其主要成分是MnO2,含少量Al2O3和SiO2。闪锌矿主要成分是ZnS,含少量FeS、CuS、CdS等杂质,晶体属于六方晶系。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下。

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式___________________。
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是_________________。
(3)步骤③中MnO2的作用是________________,另外一种物质X可以是__________。
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____________________。
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为_______________________。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10-15]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com