
分析 (1)A为金属单质,若B为淡黄色固体,则A为Na,B为Na2O2;
(2)若A为生活中常用金属,且C中所含金属元素存在两种价态,则A为Fe,B为Fe3O4,C为FeCl3、FeCl2混合;
(3)若B为两性氧化物,则A为Al,C为AlCl3,D为Al(OH)3,E为NaAlO2.
解答 解:(1)A为金属单质,若B为淡黄色固体,则A为Na,B为Na2O2.
A与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,
B做潜水艇供氧剂的原理为:2Na2O2+2CO2=2Na2CO3+O2 、2Na2O2+2H2O=4NaOH+O2↑,
故答案为:Na;2Na+2H2O=2Na++2OH-+H2↑;2Na2O2+2CO2=2Na2CO3+O2 、2Na2O2+2H2O=4NaOH+O2↑;
(2)若A为生活中常用金属,且C中所含金属元素存在两种价态,则A为Fe,B为Fe3O4,C为FeCl3、FeCl2混合.
Ⅰ.A与水反应的方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ;
Ⅱ.给C溶液中加入过量的氢氧化钠,并露置在空气中一段时间,整个过程中发生的氧化还原反应的方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
Ⅲ.若想将C中金属元素转化成单一价态,可加入适量的Cl2或Fe,
故答案为:Cl2;Fe;
Ⅳ.与Fe反应消耗1mol O2得到Fe的氧化物,铁的氧化物与盐酸反应时,氧原子与HCl中H原子结合为水,则需要HCl为4mol,反应需要2mol/L盐酸溶液体积为$\frac{4mol}{2mol/L}$=2L,
故答案为:2;
(3)若B为两性氧化物,则A为Al,C为AlCl3,D为Al(OH)3,E为NaAlO2.
Ⅰ.A与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
Ⅱ.实验室制备氢氧化铝在的离子方程式:Al3++3 NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3 NH3•H2O=Al(OH)3↓+3NH4+;
Ⅲ.氧化铝为51g,物质的量为$\frac{51g}{102g/mol}$=0.5mol,可以得到氯化铝为1mol,在氯化铝溶液中加入1mol/L NaOH 溶液1L时开始出现沉淀,若要得到0.5mol的沉淀,而氯化铝完全反应会得到1mol沉淀,等于0.5mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,开始加入1L NaOH溶液中和未反应的HCl,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.5mol×3=1.5mol,消耗NaOH溶液的体积为$\frac{1.5mol}{1mol/L}$=1.5L,故加入NaOH溶液体积为1L+1.5L=2.5L;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
1mol 3mol 1mol
溶解的氢氧化铝为1mol-0.5mol=0.5mol,
Al(OH)3+OH-═AlO2-+2H2O
0.5mol 0.5mol
则消耗的碱的物质的量为3mol+0.5mol=3.5mol,NaOH溶液的体积为$\frac{3.5mol}{1mol/L}$=3.5L,
故加入NaOH溶液的体积为:1L+3.5L=4.5L,
故答案为:2.5;4.5.
点评 本题考查无机物推断,涉及Na、Fe、Al元素单质化合物性质与转化,是对学生综合能力的考查,Ⅲ中计算为易错点,学生溶液忽略开始加入的NaOH,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
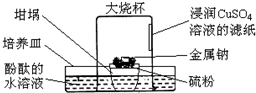 倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )| A. | 水是钠与硫反应的催化剂 | B. | 酚酞的水溶液变红色 | ||
| C. | 钠与硫的反应是放热反应 | D. | 滤纸逐渐变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发利用了溶质的溶解性随温度升高而降低的性质 | |
| B. | 蒸馏利用了液体沸点不同的性质 | |
| C. | 萃取利用了物质在不同溶剂中溶解度不同的性质 | |
| D. | 分液利用了两种液体互不相溶且密度不同的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Mg2+、Cl-、NO3- | B. | Al3+、K+、SO42-、OH- | ||
| C. | Fe2+、H+、SO42-、NO3- | D. | Na+、OH-、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖能发生水解反应生成乙醇和二氧化碳 | |
| B. | 氨基乙酸、氯乙烯、乙二醇均可发生聚合反应 | |
| C. | 实验室用溴乙烷在浓硫酸、170℃条件下制备乙烯 | |
| D. | 苯酚能跟碳酸钠溶液反应,苯酚的酸性比碳酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰和水之间的相互转化是化学变化 | |
| B. | 溶于水能导电的化合物一定是电解质 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=+92.4KJ/mol | B. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=-92.4KJ/mol | ||
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8KJ/mol | D. | H2(g)+Cl2(g)═2HCl(l)△H=+184.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
设NA表示阿伏伽德罗常数的值,下列说法中正确的是
A.1molNH4+所含质子数为10 NA
B.6.8g液态KHSO4中含有0.1NA个阳离子
C.常温常压下,22.4 LSO2所含的分子数为NA
D.常温常压下,32 gO2和O3的混合气体所含原子数为 2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com