

| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | 不能确定Na+和Cl-是否存在,CO${\;}_{3}^{2-}$一定不存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)≥0.1mol•L-1 |
分析 pH=1的溶液中存在大量氢离子,则一定不存在CO32-;向溶液中通入氯气分液后得到紫色溶液,则原溶液中含有I-,铁离子能够氧化碘离子,则一定不存在Fe3+;水层中加入氢氧化钠溶液得到固体,该固体为氢氧化亚铁,灼烧固体得到的1.60g为氧化铁,则溶液中一定存在Fe2+,然后结合碘单质的质量、氧化铁的质量及电荷守恒判断氯离子的存在情况及浓度.
解答 解:pH=1的溶液中氢离子浓度为0.1mol/L,100mL该溶液中含有氢离子的物质的量为0.01mol,则一定不存在CO32-;
向溶液中通入氯气分液后得到紫色溶液,则原溶液中含有I-,铁离子能够氧化碘离子,则一定不存在Fe3+;2.54g为碘单质,物质的量为$\frac{2.54g}{254g/mol}$=0.01mol,原溶液中含有碘离子的物质的量为0.02mol;
水层中加入氢氧化钠溶液得到固体,该固体为氢氧化亚铁,灼烧固体得到的1.60g为氧化铁,则溶液中一定存在Fe2+,根据铁元素守恒可知亚铁离子的物质的量为:$\frac{1.60g}{160g/mol}$×2=0.02mol,0.02mol亚铁离子带有正电荷为0.04mol,0.02mol碘离子带有0.02mol电子,所以原溶液中一定含有Cl-,其物质的量至少为0.04mol-0.02mol-0.01mol=0.01mol,氯离子的浓度最小为$\frac{0.01mol}{0.1L}$=0.1mol/L,
A.根据分析可知,原溶液中一定含有Fe2+、I-、Cl-,故A正确;
B.原溶液中一定不存在CO32-,一定含有Cl-,故B错误;
C.原溶液中一定存在Fe2+,一定不存在Fe3+,故C错误;
D.根据分析可知该溶液中c(Cl-)≥0.1nol•L-1,故D正确;
故选AD.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,根据电荷守恒判断氯离子的存在情况为易错点,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g N20含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 1L lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 实验室用排饱和食盐水的方法手机氯气 | |
| D. | 合成氨是放热反应,采用在较高温度下进行反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 向苯和苯酚混合溶液中滴加过量浓溴水 | 除去混合溶液中的苯酚 |
| B | 向待测液中加入饱和碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3mL5%CuSO4溶液中滴加3-4滴1%氢氧化钠溶液,再向其中加入0.5mL乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

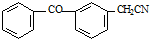 由C→D的反应类型是取代反应
由C→D的反应类型是取代反应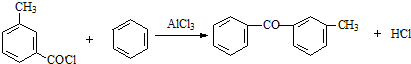

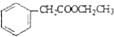 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH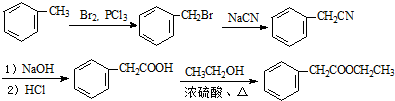 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 漂白粉溶液中加入醋酸:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com