
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A. 常温常压下,2.24 L H2O中含有极性共价键的数目为0.2NA
B. 0.1 mol·L-1NH4Cl溶液中含有NH![]() 的数目小于0.1NA
的数目小于0.1NA
C. 100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA
D. 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
【答案】D
【解析】
试题A、常温常压下,2.24 L H2O的物质的量不是0.1mol,因此其中含有极性共价键的数目不是0.2 NA,A错误;B、0.1 mol·L-1NH4Cl溶液中NH4+的浓度小于0.1mol/L,但不能确定溶液的体积,因此不能计算含有的数目,B错误;C、100 mL 12 mol·L-1的浓HNO3的物质的量是1.2mol,与过量Cu反应,随着反应的进行,浓度降低,因此在反应过程中既有NO2,也有NO生成,则不能计算转移电子的数目,C错误;D、标准状况下,11.2 L由CH4和C2H4组成的混合气体的物质的量是0.5mol,二者均还有4个氢原子,因此其中含有氢原子的数目为2NA,D正确,答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对三联苯是一种有机合成中间体,工业上合成对三联苯的化学方程式为![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯分子中至少有16个原子共平面
C. 对三联苯的一氯取代物有4种
D. 0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为电化学降解NO![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
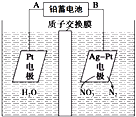
A. 铅蓄电池的A极为阴极
B. 电解的过程中有H+从右池移动到左池
C. 该电解池的阴极反应为:2NO3- + 6H2O + 12e- = N2↑ + 12OH-
D. 若电解过程中转移1moL电子,则交换膜两侧电解液的质量变化差为7.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
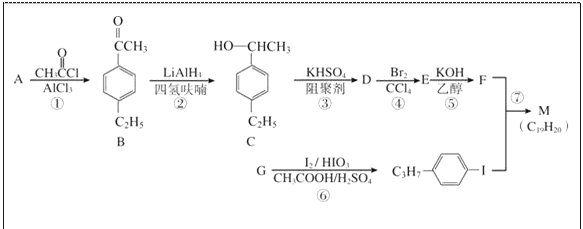
回答下列问题:
(1)A的分子式为____________。
(2)D中含有的官能团是____________,分子中最多有____________个碳原子共平面。
(3)①的反应类型是____________,③的反应类型是____________。
(4)⑤的化学方程式为________________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线: _____________。
的合成路线: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A. 化合反应和复分解反应不可能是氧化还原反应
B. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C. 含有最高价元素的化合物不一定具有很强的氧化性
D. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是________(填写字母代号)。
A.铝的表面生成致密的薄膜 B.大理石雕像被酸雨腐蚀毁坏
C.食物腐败 D.燃放烟花
(2)过氧化氢水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl==2NaCl+H2O2 B.Ag2O+H2O2==2Ag+O2↑+H2O
C.2H2O2==2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH==2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)________,H2O2既体现氧化性又体现还原性的反应是________。
②H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为________。
(3)氯化铵常用于焊接金属。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为____CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。
②反应中若产生0.2 mol的气体,则有________mol的电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
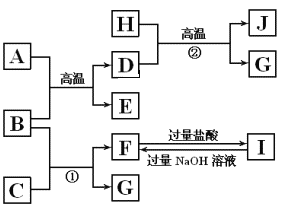
根据图示回答问题:
(1)写出下列物质的化学式:A ______,E______;
(2)反应①的化学方程式是_________________________ ;
反应②的化学方程式是___________________________ ;
(3)J与盐酸反应的化学方程式是______________________ ;
反应后的溶液与足量的D反应的离子方程式是______________________,如何检验最后溶液中的阳离子:______________________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。
(实验目的)探究金属的成分
(提出假设)猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是______;
猜想4:M的成分是铁、铜和铝
(设计实验)取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1L和V2L(所测定的气体体积已折合成标准状况)。

(1)完成实验目的和猜想填空内容。________
(2)若该实验需要0.50mol/LNaOH溶液240mL,用规格仪器配制时应称量____g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度_____(填“偏大”、“偏小”或“无影响”)
(3)进行实验1前,B瓶中的水没有装满,使测得的气体体积_______(填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为_____________并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
(4)若V1≠0,则推测上述猜想________(填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1________V2(填“>”、“<”或“=”)。
(5)若V1<V2≠0,则M样品中铁的质量为____________g(用含V1和V2式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
(1)写出该反应的反应方程式:______________;并指明该氧化还原反应的还原剂是 ______,氧化剂是______________。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 __________ ;烧瓶底部放置了几片碎瓷片,其作用是___________ 。
(3)酒精灯和酒精喷灯点燃的顺序是 ____________,为什么______________。
(4)试管中收集气体是_________,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 _____________ 。
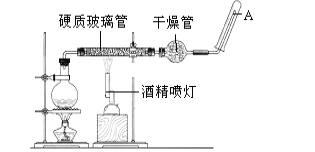
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com