

| A. | 含SO2的烟气若不经过海水脱硫直接排放可造成酸性降雨 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同 |
分析 A.含SO2的烟气若不经过海水脱硫直接排放二氧化硫被氧化为三氧化硫,溶于水生成硫酸;
B.根据使用空气中的氧气将H2SO3氧化来分析;
C.利用酸碱反应分析混合的目的;
D.“排放”出来的海水体积与进入吸收塔的天然海水的体积不同.
解答 解:A.含SO2的烟气若不经过海水脱硫直接排放二氧化硫被氧化为三氧化硫,溶于水生成硫酸,含SO2的烟气若不经过海水脱硫直接排放可造成酸性降雨,故A正确;
B.天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、HSO3-、SO32-等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4,故B正确;
C.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),故C正确;
D.从框图可知:烟雾中含有二氧化硫,溶液海水,生成亚硫酸,后经过氧气的氧化,转化为硫酸根,故排放”出来的海水中硫酸根浓度大于进入吸收塔海水的浓度,故D错误;
故选D.
点评 本题考查了含硫烟气的处理,利用所学知识结合框图信息是解答本题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
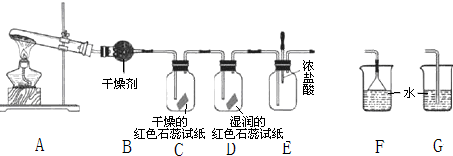

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
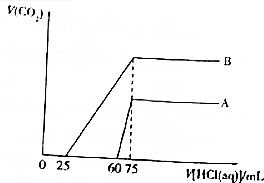 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=55.65kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.65kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.4kJ/mol | |
| D. | CH4(g)+2O2═CO2+2H2O△H=890.4kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com