

分析 木炭粉与浓硫酸反应化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,用无水硫酸铜检验水蒸气,用品红溶液检验二氧化硫,用澄清石灰水检验二氧化碳,由于二氧化硫与澄清石灰水也产生白色沉淀,故检验二氧化碳前需要除去二氧化硫,品红溶液A检验SO2,通过酸性高锰酸钾溶液除去SO2,品红溶液B检验二氧化硫除尽,品红溶液B不褪色,澄清石灰水变浑浊,说明生成二氧化碳.
解答 解:(1)木炭粉与浓硫酸反应化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)实验利用白色硫酸铜遇到水变为蓝色证明含有水蒸气,①中无水硫酸铜的作用是:检验反应生成的水蒸气,
故答案为:检验反应生成的水蒸气;
(3)因SO2和CO2都能使石灰水变浑浊,因此要想检验出C02,就要先把SO2检验了,并除掉SO2,这样石灰水变浑浊才能说明有CO2,所以高锰酸钾溶液是吸收二氧化硫的作用,
故答案为:除去混合气体中的SO2;
(4)②中两次用到品红溶液,品红溶液A检验生成的SO2气体,通过酸性高锰酸钾溶液除去SO2,品红溶液B验SO2是否除尽,
故答案为:检验生成的SO2气体;检验SO2是否除尽;
(5)③是检验二氧化碳气体存在的实验装置,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,反应现象是生成白色沉淀;
故答案为:出现白色沉淀;
(6)盛酸性高锰酸钾溶液的洗气瓶中发生反应的离子方程式是:5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+,
故答案为:5SO2+MnO4-+2H2O=2Mn2++5SO42-+4H+.
点评 本题考查物质检验实验方案的设计,侧重分析与实验能力的考查,关键是排除干扰、理解检验的顺序.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
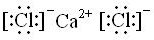 ,属于离子化合物.
,属于离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
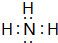 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.用氧化铁作外墙涂料 | B.铸造司母戊鼎 | C.火法炼铜 | D.淘金制饰品 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com