
| A. | 该装置能将电能转化为化学能 | B. | 实验过程中铜片逐渐溶解 | ||
| C. | 铁片上会析出红色的铜 | D. | 电子由铁片通过导线流向铜片 |
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准酸液滴定未知碱液时,若酸式滴定管未润洗,则测定结果偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
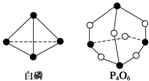 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )| A. | 吸收1 638 kJ能量 | B. | 放出1 638 kJ能量 | ||
| C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用澄清的石灰水鉴别SO2和CO2 | |
| B. | SO2能使溴水、KMnO4溶液迅速褪色 | |
| C. | 硫粉在过量的氧气中燃烧可得到SO3 | |
| D. | 少量SO2通入到浓的CaCl2溶液能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
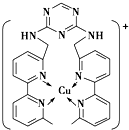 铜、碳、氮、硫、氯等是组成物质的重要元素.
铜、碳、氮、硫、氯等是组成物质的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,反应类型是加聚反应.
,反应类型是加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com