
分析 (1)A是固体,增大A的量,A的浓度不变,平衡不移动;
(2)增加B的量,B的浓度增大,瞬间正反应速率加快,而逆反应速率不变,平衡正向移动;
(3)减少C的量,逆反应速率减小,平衡正向移动;
(4)减小容器的压强,正逆反应速率减小,平衡向气体体积增大的方向移动;
(5)增大压强正逆反应速率加快,而两边气体的计量数相等,平衡不移动;
(6)升高温度,正逆反应速率加快,平衡向吸热反应方向移动;
(7)使用正催化剂,正逆反应速率同等加快,平衡不移动;
(8)恒压下,充入非反应气体(若n<p+q),体积膨胀,相当于减压.
解答 解:(1)A是固体,增大A的量,A的浓度不变,平衡不移动,故答案为:不;
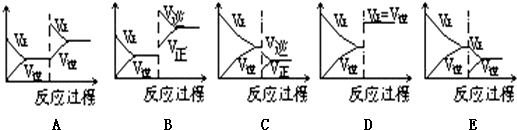
(2)增加B的量,B的浓度增大,瞬间正反应速率加快,而逆反应速率不变,平衡正向移动,所以图象为:A,故答案为:正;A;
(3)减少C的量,逆反应速率减小,平衡正向移动,图象为:E,故答案为:正向;E;
(4)减小容器的压强,正逆反应速率减小,平衡向气体体积增大的方向移动,即逆反应方向移动,图象为:C,故答案为:逆向;C;
(5)增大压强正逆反应速率加快,而两边气体的计量数相等,平衡不移动,所以图象为:D,故答案为:不;D;
(6)升高温度,正逆反应速率加快,平衡向吸热反应方向移动,逆反应是吸热反应,图象为:B,故答案为:逆向;B;
(7)使用正催化剂,正逆反应速率同等加快,平衡不移动,所以图象为:D,故答案为:不;D;
(8)恒压下,充入非反应气体(若n<p+q),体积膨胀,相当于减压,平衡向正反应方向移动,故答案为:正向.
点评 本题考查化学平衡的影响因素,为高考常见题型,侧重于学生的分析能力的考查,注意把握方程式的特征以及影响因素,学习中注意积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式: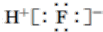 | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | NH3的结构式: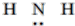 | D. | N3-的结构示意图: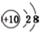 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水比硫化氢气体稳定 | B. | 水的熔沸点比硫化氢高 | ||
| C. | 氯化氢气体易溶于水 | D. | 过氧化氢易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯从溴水中萃取溴、氯化钠潮解 | B. | 海水蒸馏制淡水、石油裂化 | ||
| C. | 碘的升华、煤的气化 | D. | 石油分馏得到汽油、SO2漂白草帽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com