
���� ��1�������ֻ��������ʹ��ɵ��ǻ���������Ԫ�ع��ɣ�����һ������Ԫ�صĻ�����Ϊ������������������ȫ���������ӵĻ�����Ϊ��������������ȫ�����������Ļ�����Ϊ����������������������ӡ��������ǽ������ӻ�笠����ӵĻ�����Ϊ�Σ��������ȫ�к����ɵ����������Σ���̼Ԫ�صĻ�����Ϊ�л���������������ܺͼӦ�����κ�ˮ�������������ķǽ���������������������������������ܺ��ᷴӦ�����κ�ˮ����������ܺ��ᡢ�Ӧ�����κ�ˮ�����ڲ�����������ܺ��ᷴӦͬʱ���ܺͼӦ�����κ�ˮ��������������������������ݴ˷�����
��2���ٸ���1����������к���4����ԭ�ӷ�����Ħ��������λ��g/mol�������Ħ����������ֵ�ϵ�������Է���������
����ԭ������ȣ�����2H2O����CO2�����ݴ˹�ϵʽ���㣻
�۸���n=$\frac{N}{{N}_{A}}$���㣬��ԭ������ȣ�����2O3����3O2�����ݴ˹�ϵʽ���㣮
��� �⣺��1����H2O����������ܺ��ᡢ�Ӧ�����κ�ˮ�����ڲ�����������ڿ�����Ҫ�ɵ������������ɣ��ǻ�����Mg�ǵ��ʣ���CaO��������ܺ��ᷴӦ�����κ�ˮ����Ϊ�����������H2SO4�Ƕ�Ԫǿ���Ca��OH��2�Ƕ�Ԫǿ���CuSO4.5H2O������������Ӻ�ͭ�����Լ��ᾧˮ���ɵ����Σ������ǵⵥ�ʺ;ƾ���ɵĻ�����ƾ����л����еĴ�����NaHCO3������̼�����ʽ�Σ�⑪Na2O2��������ܺ��ᷴӦ�����κ�ˮ�������������ڼ��������⑫CO����������ڲ����������⑬SiO2�ܺͼӦ�����κ�ˮ���������������⑭SO3�ܺ��ᷴӦ�����κ�ˮ���������������⑮����Ϊ̼���ƣ��������Σ�⑯Al��OH��3���������������������������ڻ������Ǣڢࣻ������������Ǣ٢�⑪⑫⑬����������� �ݣ������ε��� �ߢ�⑮���������ε��� ��⑮�������л������ ������������������⑬⑭�����ڼ�����������Ǣܣ��������������������⑯��
�ʴ�Ϊ���ڢࣻ�٢�⑪⑫⑬���ݣ��ߢ�⑮����⑮�� �⑬⑭���ܣ�⑯��
��2����1��1����������к���4����ԭ�ӣ���1mol H2SO4�й�����H2SO4���Ӻ���4NA����ԭ�ӣ������Ħ����������ֵ�ϵ�������Է������������������Ħ��������98g/mol��
�ʴ�Ϊ��4NA��98g/mol����
����ԭ������ȣ�����2H2O����CO2��1.5mol CO2�к��е���ԭ������3mol H2O�������е���ԭ������ȣ�
�ʴ�Ϊ��3��
��3.01��1023��O2�����ʵ�����n=$\frac{N}{{N}_{A}}$=$\frac{3.01��1{0}^{23}}{6.02��1{0}^{23}}$=0.5mol����ԭ������ȣ�����2O3����3O2���������ʵ�����ȵij�����O3����������ԭ��Ϊ1.5NA����
�ʴ�Ϊ��0.5mol��1.5NA��
���� ���⿼��������Ρ�������ĸ�����ʵ����йؼ��㣬Ϊ��Ƶ���㣬�������ʵijɷֺ����Ҫ���ǽ���ؼ���ע��Ħ��������λ��g/mol��ע����ӹ��ɣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
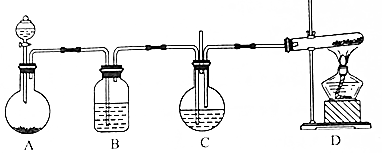
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
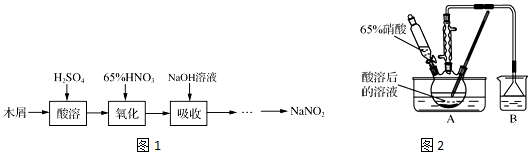
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �⻯ѧ���� | B�� | ˮ�帻Ӫ���� | C�� | �����ն� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ˮ��Cl2+H2O�T2H++Cl-+ClO- | |
| B�� | �����ʵ�����Ba��OH��2��NH4HSO4��ϡ��Һ�з�Ӧ��Ba2++2OH-+2H++SO42-�TBaSO4��+2H2O | |
| C�� | NaOH��Һ������Ca��HCO3��2��Һ��Ӧ��Ca2++2HCO3-+2OH-�TCaCO3��+CO32-+2H2O | |
| D�� | ��Al2��SO4��3��Һ�м��������ˮ��Al3++3NH3•H2O�TAl��OH��3��+3NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Li��Be��Bԭ�������������������� | |
| B�� | P��S��ClԪ�ص���������������� | |
| C�� | Li��Na��K�Ľ��������μ��� | |
| D�� | N��O��Fԭ�Ӱ뾶�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | c��CO32-���Ĵ�С��ϵΪ���ڣ��ݣ��ۣ��ܣ��� | |
| B�� | ����Һ�������պ�ֻ�Тٲ��ܵõ���Ӧ�Ĺ������� | |
| C�� | �ۢܢݼ��������ᷴӦ��������NaOH��Һ��Ӧ | |
| D�� | c��HCO3-���Ĵ�С��ϵΪ���ܣ��ۣ��ݣ��ڣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
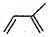 ���Ǻϳ���Ȼ�ĵ��壮��ش��������⣺
���Ǻϳ���Ȼ�ĵ��壮��ش��������⣺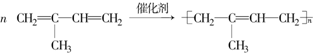 ���÷�Ӧ����Ϊ�Ӿ۷�Ӧ��
���÷�Ӧ����Ϊ�Ӿ۷�Ӧ��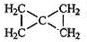 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧ�� | H-H | Cl-Cl | H-Cl |
| ���� | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A�� | $\frac{1}{2}$H2��g��+$\frac{1}{2}$Cl2��g���THCl��g����H=-91.5kJ/mol | |
| B�� | H2��g��+Cl2��g���T2HCl��g����H=-183kJ/mol | |
| C�� | $\frac{1}{2}$H2��g��+$\frac{1}{2}$Cl2��g���THCl��g����H=+91.5kJ/mol | |
| D�� | 2HCl��g���TH2��g��+Cl2��g����H=+183 kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com