
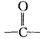 官能团.
官能团.| 110×47.76% |
| 16 |
| 150×47.76% |
| 16 |
| 110×47.76% |
| 16 |
| 150×47.76% |
| 16 |
| 4×16 |
| 47.76% |
| 70 |
| 12 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
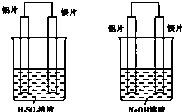 有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示:
有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
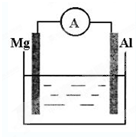 如图所示,组成一个原电池.
如图所示,组成一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO和NO2的密度都比空气大,都可以用向上排空气法收集 |
| B、丙烷和乙醇的分子量相近,二者沸点也相近 |
| C、SO2和CO2都是酸性氧化物,都能与KOH溶液反应 |
| D、Na2O和Na2O2所含元素相同,故与CO2反应产物也相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com