
【题目】化学是一门以实验为基础的学科。回答下列问题:
(1)认识仪器是正确使用仪器的前提。

写出上述仪器的名称:A___________;B__________;C_________。
(2)实验室利用胆矾晶体和烧碱制备氧化铜固体时,其实验操作如下:
Ⅰ.混合 Ⅱ.过滤 Ⅲ.加热分解 Ⅳ.溶解 Ⅴ.洗涤
就此实验完成下列填空:
①正确的操作步骤是______________(填罗马数字)。
②操作Ⅱ中用到的玻璃仪器除烧杯、玻璃棒外,还需要用到上述仪器中的________(填字母)。
③在实验中多次用到玻璃棒,其作用有三个,分别是______、_______和转移。
【答案】漏斗 冷凝管 分液漏斗 Ⅳ、Ⅰ、Ⅱ、Ⅴ、Ⅲ A 搅拌 引流
【解析】
(1)根据仪器的外形来分析;
(2)硫酸铜晶体和烧碱溶液反应生成氢氧化铜,过滤、洗涤沉淀,加热分解生成氧化铜,以此解答该题。
(1)根据仪器的外形可知,A为漏斗,B为冷凝管,C为分液漏斗;
(2)①实验室利用硫酸铜晶体和烧碱溶液制备氧化铜固体,可将晶体溶解,混合后发生反应生成氢氧化铜沉淀,将沉淀过滤、洗涤,然后将氢氧化铜灼烧,分解可生成氧化铜,顺序为Ⅳ、Ⅰ、Ⅱ、Ⅴ、Ⅲ;
②步骤II为过滤,所用到的玻璃仪器有玻璃棒、漏斗、烧杯,故除了玻璃棒和漏斗外,还需要上述仪器中的A;
③此实验中,多次用到玻璃棒,在溶解时的作用为搅拌加速溶解,在过滤操作中作用为引流,在蒸发操作中的进行搅拌,防止液体局部过热使液体飞溅并转移药品。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 + 3Cl2 +10KOH![]() 2 K2FeO4 + 6KCl +8H2O在该反应中,还原剂是____________,当反应中有1mol K2FeO4生成时,消耗的Cl2在标况下的体积为____________L,转移电子的数目为____________。
2 K2FeO4 + 6KCl +8H2O在该反应中,还原剂是____________,当反应中有1mol K2FeO4生成时,消耗的Cl2在标况下的体积为____________L,转移电子的数目为____________。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:_____________________________________________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:_____。
(4)工业上制漂白粉的化学方程式为________________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_________________________。
(5)KAl(SO4)2·12H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
(6)硅酸钠水溶液的俗名为__________,可作为木材_______________的原料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。
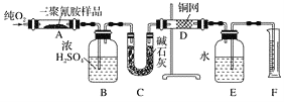
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____。
(2)需要加热的装置是____(填字母代号)。
(3)装置D的作用是_____。
(4)F处读数时应该注意的是____、_____。
(5)三聚氰胺的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是____________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:____________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________________________。
(4)写出e的单质在空气中燃烧所得产物的电子式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月27日,科技日报报道中科院大连化学物理研究所创新性地提出锌碘单液流电池的概念,锌碘单液流电池中电解液的利用率达到近100%,进而大幅度提高了电池的能量密度,工作原理如图所示。下列说法不正确的是( )

A.该电池放电时电路中电流方向为B→b→a→A
B.M为阴离子交换膜,N为阳离子交换膜
C.如果使用铅蓄电池进行充电,则a电极应连接铅蓄电池中的Pb电极
D.若充电时C区增加的离子数为2NA,则A极增重65g
查看答案和解析>>
科目:高中化学 来源: 题型:
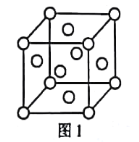
【题目】已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序数依次增大。a、c的基态原子中均有2个未成对电子,c与d位于同一主族,元素e的基态原子的3d轨道上有2个电子,基态f原子M层有2个未成对电子且位于第Ⅷ族。
(1)元素e在周期表中的位置为___;f的单质的晶胞结构如图1所示,该晶胞为___堆积。
(2)c元素可分别与a、b元素组成多种简单阴离子,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有___(填离子符号)。一个氢原子与一个a原子、一个b原子组成的分子中σ键和π键的数目之比为___。
(3)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有___(填元素符号)。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),d元素的低价酸性氧化物其大π键应表示___。
),d元素的低价酸性氧化物其大π键应表示___。
(5)c、f元素形成的一种晶体的晶胞结构如图2所示,其单原子层堆积结构实际如图3所示。
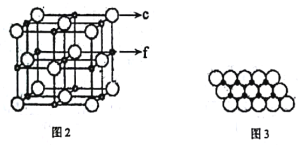
该①晶体的化学式是___。
②如图3中,c离子之间最短核间距为apm,NA表示阿伏加德罗常数的值。则该晶体中1m2单原子层的质量为___(用含a和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为35.5b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于收集SO2并验证其某些化学性质,关于该实验的现象和结论描述有误的是

A.①中石蕊试液先变红后褪色,说明SO2溶于水呈酸性且有漂白性
B.②中品红溶液褪色,说明SO2有漂白性
C.③中硫化氢水溶液变浑浊,说明SO2有氧化性
D.④中酸性KMnO4溶液褪色,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是
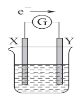
A.外电路中的电流方向为:X→外电路→Y
B.若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两个电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com