
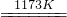 aTiCl4+cCO 反应(1)
aTiCl4+cCO 反应(1)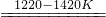 Ti+2MgCl2 反应(2)
Ti+2MgCl2 反应(2)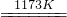 aTiCl4+cCO,该反应中反应前后,碳元素的化合价升高,碳单质作还原剂,氯元素的化合价降低,氯气作氧化剂,还原产物是TiCl4;
aTiCl4+cCO,该反应中反应前后,碳元素的化合价升高,碳单质作还原剂,氯元素的化合价降低,氯气作氧化剂,还原产物是TiCl4;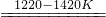 Ti+2MgCl2 该反应中钛元素的化合价降低,TiCl4作氧化剂;所以TiCl4在反应I中是还原产物,在反应II中是氧化剂,故正确;
Ti+2MgCl2 该反应中钛元素的化合价降低,TiCl4作氧化剂;所以TiCl4在反应I中是还原产物,在反应II中是氧化剂,故正确; 所以
所以 ,故正确;
,故正确;

科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1173K |
| 1220K→1420K |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、TiCl4在反应(1)中是氧化产物,在反应(2)中是氧化剂 |
| B、C、Mg在反应中均为还原剂,被氧化 |
| C、在(1)反应方程式中,a一定等于2 |
| D、每生成9.6g Ti,反应(1)、(2)中共转移电子均为0.6mol |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川中江县龙台中学理补化学卷 题型:选择题
金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:aTiO2 + bCl2 + cC  aTiCl4 + cCO
反应①
aTiCl4 + cCO
反应①
TiCl4 +2Mg  Ti + 2MgCl2 反应②
Ti + 2MgCl2 反应②
关于反应①、②的分析不正确的是
① TiCl4在反应①中是还原产物,在反应②中是氧化剂;② C、Mg在反应中均为还原剂,被还原;③ 在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;④ a=1,b=c=2;⑤ 每生成19.6 g Ti,反应①、②中共转移4.8 mol e-。 (Ti 相对原子质量49)
A.①②④ B.②③④ C.③④ D.②⑤
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| ||
| ||
| A.①②④ | B.②③④ | C.③④ | D.②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com