
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
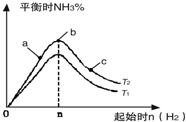
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | 0 | ||||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
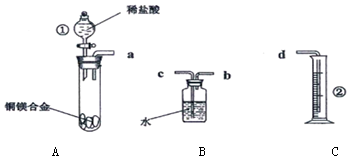
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | 物质的量表示含有一定数目粒子的集体 | |
| C. | 物质的量是国际单位制中的一个基本单位 | |
| D. | 摩尔是计量原子、分子或离子等微观粒子的“物质的量”的单位 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com