
����Ŀ��Ŀǰ��﮵������չ������ﮡ�����ﮡ���̼������������﮵ȵ����ϵ����ش��������⣺
��1����̬Niԭ�ӵļ۵����Ų�ʽΪ________����Niͬ�����һ�̬ԭ�Ӻ���ijɵ���������Ni��ͬ��Ԫ�ػ���__________�֡�
��2��̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ����������Ϊ�����ӣ������е�ԭ�ӵ��ӻ�����Ϊ___��
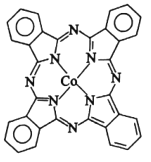
��3��Li�������ѳ�����﮵�ؽṹ̮������O2����ը��ʵ��֤ʵO2����е����Ӷ���Ϊ˳���Է��ӡ����нṹʽ���ڵ�������ӣ������п��ܴ���O2���ӽṹ����__������ĸ����
A ![]() B
B ![]() C
C ![]() D
D ![]()
��4����ͼΪSiO2������Siԭ����z�᷽����xyƽ���ͶӰͼ��������ͶӰͼ��������Oԭ����ȥ��Siԭ���Ա�ע�����ֱ�ʾÿ��Siԭ��λ��z��ĸ߶ȣ���SiA��SiB�ľ�����______��
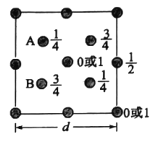
��5��PCl5����ľ�����ͼ��ʾ���þ�������ʱ�γ�һ���ܵ����Һ�壬ʵ�������к���һ���������������Ӻ�һ���������������ӣ���P��Cl���ļ���ֻ��198pm��206pm���֣����õ��뷽��ʽ����PCl5�����ܵ����ԭ��____�������������������м��Ǵ���PCl3�ļ���ԭ��Ϊ_____����֪�þ���ľ����߳�Ϊapm��NAΪ����٤��������ֵ����þ�����ܶ�Ϊ__________g��cm��3��

���𰸡�![]() 3
3 ![]() ��
��![]() B
B ![]()
![]()
![]() ������Pԭ����һ�Թ¶Ե��ӣ�
������Pԭ����һ�Թ¶Ե��ӣ�![]() ��Pû�й¶Ե��ӣ��¶Ե��ӶԳɼ����ӵ��ų������ڳɼ����ӶԼ���ų���
��Pû�й¶Ե��ӣ��¶Ե��ӶԳɼ����ӵ��ų������ڳɼ����ӶԼ���ų��� ![]()
��������
(1)NiԪ��Ϊ28��Ԫ�أ����������Ų�Ϊ1s22s22p63s23p63d84s2������۵����Ų�ʽΪ3d84s2��Niԭ�Ӻ�������е�������2����ͬ���ڵ�����ͬ��2������3��Ԫ�أ��۵����Ų��ֱ�Ϊ3d24s2��4s24p2��4s24p4���ֱ���Ti��Ge��Se����3�֣�
(2)�÷����У�Nԭ�����γ�3���Ҽ�������1�Թ¶Ե��ӣ����γ�4��������û�й¶Ե��ӣ�������Nԭ�ӵ��ӻ����;�Ϊsp3������Nԭ���γ�2������������1�Թ¶Ե��ӣ�����Nԭ�ӵ��ӻ����;�Ϊsp2��
(3)ʵ��֤ʵO2����е����Ӷ���Ϊ˳���Է��ӡ�����ѡ����з�������֪A��C��D�е�O2���ӵĽṹʽ�У���û�е����Ӵ��ڣ���˲�������ʵ��ʵ����Bѡ��O2�Ľṹʽ�еĻ�ѧ����3�����ӣ��е����ӣ����Bʵ����ʵ��
(4)����ͼ ��֪����άģ��Ϊ
��֪����άģ��Ϊ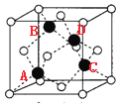 (ͼ�к���Ͱ����Ϊ��ԭ�ӣ���ԭ��λ��������ԭ��֮�䣬ʡ��)��ͼ��ABCD�ĸ�Siԭ���γ���������ṹ����AB�������AC���룬AC�����ڵ���ͶӰΪ������Խ��ߵ�һ�룬��SiA��SiB�ľ���=
(ͼ�к���Ͱ����Ϊ��ԭ�ӣ���ԭ��λ��������ԭ��֮�䣬ʡ��)��ͼ��ABCD�ĸ�Siԭ���γ���������ṹ����AB�������AC���룬AC�����ڵ���ͶӰΪ������Խ��ߵ�һ�룬��SiA��SiB�ľ���=![]() ��
��
(5))���������ƶ����ӵĻ������ܵ��磬PCl5��һ�ְ�ɫ���壬����ʱ�γ�һ���ܵ����Һ�������к���һ�����������������Ӻ�һ�����������������ӣ������ӡ������ӷֱ�ΪPCl4+��PCl6-������뷽��ʽΪ2PCl5=PCl4++PCl6-��PCl3������Pԭ����һ�Թµ��Ӷԣ�PCl4+��Pû�йµ��Ӷԣ��µ��ӶԶԳɼ����ӵ��ų������ڳɼ����ӶԼ���ų��������������������������м��Ǵ���PCl3�ļ��ǣ��þ�����PCl5����=![]() ���������=(a��10-10cm)3�������ܶ�
���������=(a��10-10cm)3�������ܶ�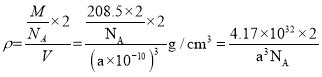 g/cm3��
g/cm3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ˮ���ܺ���Fe2+��Fe3+��Al3+��Mg2+��Na+��K+��CO32-��SO42-��ȡ��ˮ��Ʒ�ֱ������ͼ��ʾ��~���ĸ�ʵ�顣�����ƶ���ȷ����
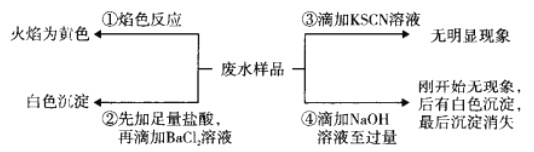
A. ��ˮ����Na+������K+
B. ��ˮ����SO42-��CO32-
C. ��ˮ����Fe3+�����ܺ�Fe2+
D. ��ˮһ������Na+��Al3+��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ����(��)�����£�CH4���������ʱ��ı仯����ͼ��ʾ��
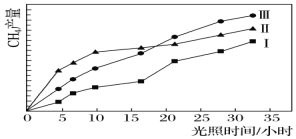
(1)��0��30Сʱ�ڣ�CH4��ƽ����������v����v����v���Ӵ�С��˳��Ϊ__________����Ӧ��ʼ���12Сʱ�ڣ��ڵ�________�ִ��������£��ռ���CH4��ࡣ
(2)������CH4��H2O(g)ͨ��۽�̫���ܷ�Ӧ����������Ӧ��CH4(g)��H2O(g)��CO(g)��3H2(g) ��H����206 kJ��mol��1��
������������ͼ�У�������Ӧ��������ϵ�����仯ͼ(���б�Ҫ��ע)��________��

�ڽ������ʵ�����CH4��H2O(g)����1 L�����ܱշ�Ӧ����ij�¶��·�Ӧ��ƽ�⣬ƽ�ⳣ��K��27����ʱ���CO�����ʵ���Ϊ0.10 mol����CH4��ƽ��ת����Ϊ________(���������λ��Ч����)��
(3)��֪��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H����802 kJ��mol��1,д����CO2����CO���Ȼ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�������һ��̫���������Ӻ�ˮ����ȡ����﮵�װ�ã�ʾ��ͼ��ͼ��ʾ����װ�ù���ʱ������˵����ȷ����
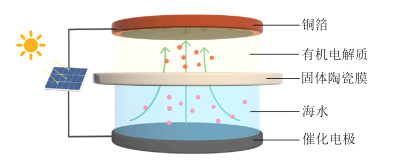
A.ͭ���ϵĵ��Ʊȴ��缫�ϵĸ�
B.��ˮ��pH���
C.��ת��1mol���ӣ�������ͭ������7g
D.�����մ�Ĥ�������ӽ���Ĥ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ĵ����ⷴӦ�������Ʊ��״������Ἲ�����÷�Ӧ�Ļ�ѧ����ʽ���£�CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
��֪v��=k����x(CH3COOCH3) ��x(C6H13OH)��v��=k����x(CH3COOC6H13) ��x(CH3OH)��������k����k��Ϊ���ʳ��������¶�Ӱ�죩��xΪ����ֵ����ʵ�����������Ӧ��ʼʱ��CH3COOCH3��C6H13OH�����ʵ���֮��1��1Ͷ�ϣ����338K��343K��348K�����¶���CH3COOCH3ת����(![]() )��ʱ��(
)��ʱ��(![]() )�ı仯��ϵ��ͼ��ʾ������˵����ȷ����
)�ı仯��ϵ��ͼ��ʾ������˵����ȷ����
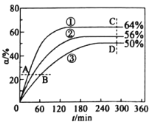
A.�÷�Ӧ����H>0
B.348Kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1.8
C.A��B��C��D�ĵ��У�v��������D
D.�����ߢ١��ڡ����У�k����k���IJ�ֵ���������Ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2NO2(g)![]() 2NO(g)+O2(g)���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
2NO(g)+O2(g)���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
A.��λʱ��������n molO2��ͬʱ������2nmolNO
B.��NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2:2:1��״̬
C.���������������ٸı��״̬
D.��������ƽ����Է����������ٸı��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С��������װ�ý����Ҵ���������ʵ�顣��֪����ȩ�ɱ�����Ϊ���ᡣ
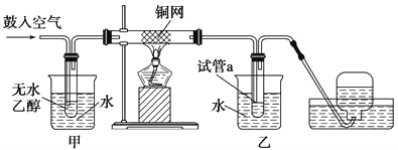
(1)ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д����Ӧ�Ļ�ѧ����ʽ__________________ ��_____________________��
(2)�ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ�����Ӧ��____________ ��Ӧ����һ���о���������������������뷴Ӧ��ϵ���¶ȹ�ϵ������ͼ��ʾ��
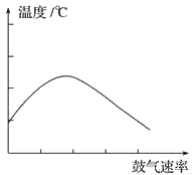
�Խ��ͳ���ͼ�������ԭ��_______________________��
(3)��������ˮԡ���ò���ͬ����������_______________���ҵ�������______________��
(4)���Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����_______��Ҫ��ȥ�����ʣ����ڻ��Һ�м���________ (��д��ĸ)��Ȼ����ͨ��________________(��ʵ���������)���ɳ�ȥ��
A.�Ȼ�����Һ B.�� C.̼��������Һ D.���Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1909��¹���ѧ�ҹ�����ʵ�����״κϳɰ����ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о����ǻ��ڿ�ѧ��ѧ��Ӧԭ����ָ����
��1����֪298Kʱ��N2��g��+3H2��g��![]() 2NH3��g������H=�C92.2kJ/mol����S=�C198.2J/(K��mol)������ݷ�Ӧ���еķ����ۺ��оݣ������ºϳɰ���Ӧ___����ܡ����ܡ����Է����С�
2NH3��g������H=�C92.2kJ/mol����S=�C198.2J/(K��mol)������ݷ�Ӧ���еķ����ۺ��оݣ������ºϳɰ���Ӧ___����ܡ����ܡ����Է����С�
��2��Ŀǰ�����о��εĻ�ѧ�̵��·�����N2�ڴ���������ˮ�������·�Ӧ��
��֪��N2(g)+ 3H2(g)![]() 2NH3(g) ��H1=��92.4kJ/mol
2NH3(g) ��H1=��92.4kJ/mol
2H2(g)+ O2(g)![]() 2H2O(l) ��H2=��571.6kJ/mol
2H2O(l) ��H2=��571.6kJ/mol
2N2(g)+ 6H2O(l)![]() 4NH3(g)+3O2(g) ��H3
4NH3(g)+3O2(g) ��H3
����H3=___kJ/mol��
��3���ϳɰ���Ӧ��һ�ܱ������з�������ͼ��ijһʱ��η�Ӧ�����뷴Ӧ���̵Ĺ�ϵ����ͼ��

��t4ʱ�̣���ϵ����ʲô���������˱仯��t4____��
������ʱ����У����İٷֺ�����ߵ���____��
A��0��t1 B��t2��t3 C��t3��t4 D��t4��t5
��4�����ݻ�Ϊ1L���ܱ�װ���У�����4mol�ϳ�����N2��H2������400��ʱ��Ӧ��N2�����������ʱ��仯��ϵ��ͼ��ʾ��
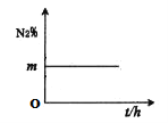
��N2��H2��Ͷ�ϱ�Ϊ____��
�ڷ�Ӧ�ﵽƽ����װ����H2���������Ϊ25%����400��ʱ���ϳɰ���Ӧ��ƽ�ⳣ��Ϊ___(���÷�����ʾ)��
���ں��º����£�N2��H2��NH3��Ͷ��Ϊ1.5mol��0.5mol��1mol��ƽ��ʱH2���������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������л��ﶼ��̼���⡢������Ԫ����ɣ�������������ȷ���ǣ�������

A.�ٺ͢ڶ����й������ǻ�B.�ٺ͢ھ������ƵĻ�ѧ����
C.�ٺ͢�Ϊͬϵ��D.�ٺ͢�������Ԫ�ص�����������ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com