
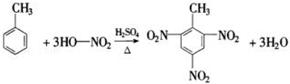
 .
.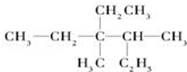 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷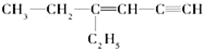 ,其中在同一平面上的碳原子至少为6个.
,其中在同一平面上的碳原子至少为6个.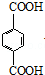 .
. 分析 (1)甲苯和硝酸反应发生取代反应,甲苯中的邻对位氢原子被硝基取代,据此书写化学方程式;
(2)物质为烷烃,选取最长碳链为主碳链,离取代基近的一端编号确定取代基位置,写出名称;
(3)根据连接四个基团(或原子)的碳原子为饱和碳原子,在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转;
(4)分子组成为C9H12的苯的同系物,已知苯环上有2个取代基可能为甲基和乙基.
解答 解:(1)甲苯和硝酸反应发生取代反应,甲苯中的邻对位氢原子被硝基取代,据此书写化学方程式为: ,
,
故答案为: ;
;
(2)有机物 ,选取最长碳链为主碳链,含6个碳原子,3,4号碳上含有甲基,3号碳上有乙基,离取代基近的一端编号确定取代基位置,写出名称用系统命名法命名得到:3,4-二甲基-3-乙基己烷,
,选取最长碳链为主碳链,含6个碳原子,3,4号碳上含有甲基,3号碳上有乙基,离取代基近的一端编号确定取代基位置,写出名称用系统命名法命名得到:3,4-二甲基-3-乙基己烷,
故答案为:3,4-二甲基-3-乙基己烷;
(3)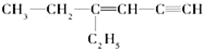 ,连接四个基团(或原子)的碳原子为分子中乙基中的碳原子,分子中有2个乙基,故分子中饱和碳原子数为4;分子中存在C≡C的直线结构,与C≡C相连的C=C中的碳原子处于乙炔的H原子位置,分子中存在C=C的平面型结构,与C=C直接相连的碳原子都在同一平面上,同时C=C中的1个碳原子与C≡C上的2个碳原子共线,所以最多在同一平面上的碳原子数为8,其中在同一平面上的碳原子至少为6个,
,连接四个基团(或原子)的碳原子为分子中乙基中的碳原子,分子中有2个乙基,故分子中饱和碳原子数为4;分子中存在C≡C的直线结构,与C≡C相连的C=C中的碳原子处于乙炔的H原子位置,分子中存在C=C的平面型结构,与C=C直接相连的碳原子都在同一平面上,同时C=C中的1个碳原子与C≡C上的2个碳原子共线,所以最多在同一平面上的碳原子数为8,其中在同一平面上的碳原子至少为6个,
故答案为:6;
(4)分子组成为C9H12的苯的同系物,已知苯环上有2个取代基可能为甲基和乙基,有邻间对3种同分异构体,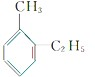 、
、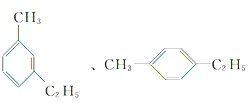 ,其苯环上的一氯代物分别有4种、4种、2种,故总共有10种,该烃被酸性高锰酸钾溶液氧化后可能形成的产物有多种,和苯环直接相连的碳原子上有氢原子,可以被氧化为羧基,如对甲乙基苯被氧化为对苯二甲酸,结构简式为:
,其苯环上的一氯代物分别有4种、4种、2种,故总共有10种,该烃被酸性高锰酸钾溶液氧化后可能形成的产物有多种,和苯环直接相连的碳原子上有氢原子,可以被氧化为羧基,如对甲乙基苯被氧化为对苯二甲酸,结构简式为: ,
,
故答案为:3;10; .
.
点评 本题考查了有机物结构与性质,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握有机物命名原则及同分异构体的书写原则,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:多选题
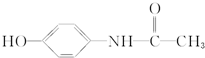 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
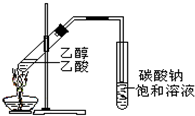 在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 2-甲基丁烷.
2-甲基丁烷. 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
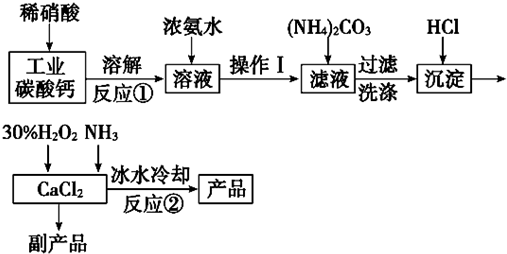
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
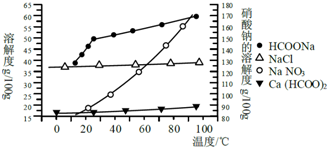
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com