
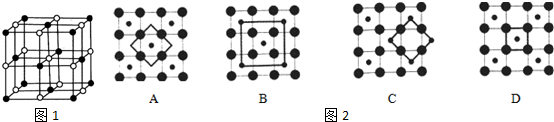
| A. | 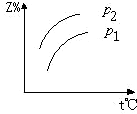 | B. |  | C. |  | D. |  |
分析 由方程式X(气)+3Y(气)?2Z(气)+热量,可知:反应放热,升高温度平衡向逆反应方向移动,
反应前气体的化学计量数之和大于生成物气体的化学计量数之和,则增大压强平衡向正反应方向移动,以此判断生成物Z的百分含量的变化.
解答 解:由方程式X(气)+3Y(气)?2Z(气)+热量,可知:反应放热,升高温度平衡向逆反应方向移动,则生成物Z的百分含量减小,可排除A、B选项;
反应前气体的化学计量数之和大于生成物气体的化学计量数之和,则增大压强平衡向正反应方向移动,则生成物Z的百分含量增大,又P1>P2,则D正确,C错误.
故选D.
点评 本题考查化学平衡移动图象问题,题目难度不大,注意从化学方程式的反应热以及化学计量数关系判断外界条件对平衡移动的影响.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,用红色石蕊试纸放在试管口检验 | |
| B. | 加水溶解,用红色石蕊试纸检验溶液的酸碱性 | |
| C. | 加入碱溶液,加热,再滴入酚酞溶液 | |
| D. | 加入苛性钠溶液,加热,用湿润的红色石蕊试纸放在试管口检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中,H2SO4和NaOH的质量 | B. | 原溶液中,H2SO4和NaOH的物质的量 | ||
| C. | 原溶液中,H+和OH-的物质的量 | D. | 原溶液中,H+和OH-的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉在稀硫酸存在下水解,取水解后的溶液加入银氨溶液并微热,看其是否产生银镜,以验证水解产物 | |
| B. | 欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液点在pH试纸上,并与标准比色卡比较 | |
| C. | 不慎将浓硫酸沾在皮肤上,应立即用NaOH溶液冲洗 | |
| D. | 将浓硫酸与乙醇按体积比3:1混合,置于圆底烧瓶中加热,使温度迅速升高到170℃以制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+H2SO4(浓) | B. | FeO+H2SO4(浓) | C. | Ba(OH)2+H2SO4 | D. | C+H2SO4(浓) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
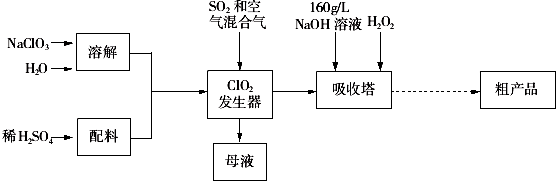
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com