(2013?肇庆一模)利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略).分析并回答下列问题:

(1)实验目的:验证SO
2的氧化性.将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO
2+2H
2S═3S+2H
2O,则在支管交叉处实验现象为
管壁内有淡黄色固体生成
管壁内有淡黄色固体生成
,硫化亚铁处加水的目的是
稀释浓硫酸,防止硫化氢被氧化
稀释浓硫酸,防止硫化氢被氧化
.
(2)实验目的:探究 SO
2与BaCl
2反应生成沉淀的条件.SO
2通入BaCl
2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀.常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是
浓氨水
浓氨水
和
生石灰(或碱石灰、固体NaOH)
生石灰(或碱石灰、固体NaOH)
,导气管A的作用是
保持集气瓶内外气压平衡
保持集气瓶内外气压平衡
以便左右两边产生的气体顺利导入
以便左右两边产生的气体顺利导入
.
(3)实验目的:铁镁合金中铁含量的测定.①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是
放低(或移动)水准管位置,使水准管、量气管内液面相平
放低(或移动)水准管位置,使水准管、量气管内液面相平
;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为
70.00%
70.00%
(精确到0.01%).




 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案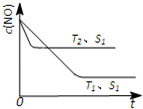 (2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.
(2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.