
| V |
| Vm |
| m |
| M |
| m |
| M |
| m(NaOH) |
| m(溶液) |
| n |
| V |
| 6.72L |
| 22.4L/mol |
| 12g |
| 0.3mol |
| 4g |
| 40g/mol |
| 4g |
| 40g |
| m |
| ρ |
| 40g |
| 1.1g/cm3 |
| n |
| V |
| 0.1mol |
| 0.0364L |


科目:高中化学 来源: 题型:

| A、只有①④ | B、只有① |
| C、只有①⑤ | D、只有①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
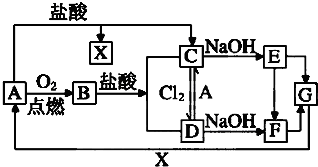 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol?L-1) | 2 | 1 | 2 | 1 |
| A、Cl- |
| B、Ba2+ |
| C、Na+ |
| D、Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com