
分析 (1)根据盐酸和氢氧化钠混合溶液中pH计算氢氧化钠浓度;
(2)NaOH溶液25.00mL和pH=3的某一元弱酸HA溶液10.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,结合氢氧化钠和HA的关系式计算HA的浓度;电离度=$\frac{已电离的浓度}{总浓度}$;
(3)电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.
解答 解:(1)设氢氧化钠的浓度为xmol/L,盐酸和氢氧化钠混合溶液中c(H+)=$\frac{0.1V-xV}{2V}$mol/L=0.01mol/L,
解得x=0.08,
故答案为:0.08mol/L;
(2)NaOH溶液25.00mL和pH=3的某一元弱酸HA溶液10.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,
设HA的浓度为ymol/L,
0.08mol/L×0.025L=ymol/L×0.01L,
y=$\frac{0.08mol/L×0.025L}{0.01L}$=0.2mol/L,
电离度=$\frac{已电离的浓度}{总浓度}$×100%=$\frac{1{0}^{-3}}{0.2}$×100%=0.5%;
故答案为:0.025 mol/L;0.5%;
(3)电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.2-1{0}^{-3}}$=5×10-6;
故答案为:5×10-6.
点评 本题考查了pH的简单计算、电离平衡常数的计算等知识点,根据物质间的关系、混合溶液的pH、电离平衡常数公式等知识点来分析解答即可,注意酸碱混合溶液中pH的计算方法,难度中等.


科目:高中化学 来源: 题型:选择题
| 方案 | 实验操作 | 现象 |
| Ⅰ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜较迅速消失 试管口产生红棕色气体 |
| Ⅱ | 将2mL2mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少但未消失 |
| Ⅲ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜较迅速消失 有白色沉淀生成 |
| A. | 方案Ⅰ说明Fe3+ 氧化了Ag | |
| B. | 方案Ⅱ涉及反应之一为Fe3++Ag?Fe2++Ag+ | |
| C. | 方案Ⅱ、Ⅲ对比说明SO42-比Cl-更易沉淀Ag+ | |
| D. | 三个方案对比说明方案Ⅰ是除去银镜的最佳方案 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) | |
| B. | NO2(酸性氧化物)、CH3CHO(有机物)、CO(无机物)、CH3COOCH3(酯) | |
| C. | HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(氧化物)、CH3I(卤代烃) | |
| D. | 液氨(氢化物)、NH4C1(铵盐)、HNO3(含氧酸)、冰水(混合物) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| ① | ② | ③ | ④ |
| 0.1mol•L-1 NaOH溶液 | pH=11 NaOH溶液 | 0.1mol•L-1CH3COOH溶液 | pH=3CH3COOH溶液 |
| A. | 由水电离出的c(H+):③>① | |
| B. | ③稀释到原来的100倍后,pH与④相同 | |
| C. | ①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) | |
| D. | ②④混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在常见的化合物中,最高价态从低至高的顺序是:C<N<O=S<Cl | |
| B. | 原子序数从小到大是:C<N<O<S<Cl | |
| C. | 排在元素周期表中所属的主族序数从大至小的是:Cl>O>S>N>C | |
| D. | 原子的最外层电子数由多至少的顺序是:Cl>O=S>N>C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 甲与丁形成的分子中有非极性分子 | ||
| C. | 简单离子半径:丁>乙>丙 | D. | 甲与乙形成的化合物均有氧化性 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:推断题
芳香酯Ⅰ的合成路线如下:
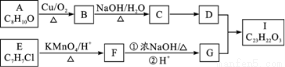
A.C8H16OE.C7H7ClI.C23H22O3
已知以下信息:①A—I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。②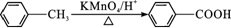
③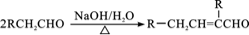
请回答下列问题:
(1)A→B的反应类型为,D所含官能团的名称为,E的名称为。
(2)E→F与F→G的顺序能否颠倒(填“能”或“否”),理由.
(3)B与银氨溶液反应的化学方程式为。
(4)I的结构简式为。
(5)符合下列要求A的同分异构体还有种。
①与Na反应并产生H2②芳香族化合物
(6)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
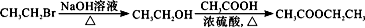
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com