
| A. | 元素周期表是元素按原子序数大小排列而成的 | |
| B. | 元素原子的电子层数等于其所在周期的周期序数 | |
| C. | 元素原子的最外层电子数等于其所在族的族序数 | |
| D. | 元素周期表中共有18列,16个族 |
分析 A.元素周期表中原子序数为周期性变化;
B.由原子结构可知元素的位置;
C.主族元素原子的最外层电子数=族序数;
D.元素周期表中共有18列,16个族.
解答 解:A.元素周期表中原子序数为周期性变化,则元素周期表是元素按原子序数大小排列而成的,故A正确;
B.由原子结构可知元素的位置,其电子层数=周期数,故B正确;
C.主族元素原子的最外层电子数=族序数,如Na最外层有1个电子,则族序数为1,即主族元素原子的最外层电子数等于其所在族的族序数,故C错误;
D.元素周期表中共有18列,16个族,故D正确;
故选C.
点评 本题考查元素周期表及应用,为高频考点,把握元素的性质及原子序数的变化、原子结构与位置的关系为解答的关键,选项C为解答的易错点,注意L层不一定为最外层,题目难度不大.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | C3H6 | B. | C2H4 | C. | C4H6 | D. | C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 1 mol OD-离子含有的质子、中子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁 | B. | N2 | C. | 铜 | D. | 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰可用于人工降雨 | |
| B. | 过氧化钠常用作航天员的供氧剂 | |
| C. | 乘车严禁携带易燃、易爆等危险品 | |
| D. | 大量开采、使用可燃冰不会对环境造成影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
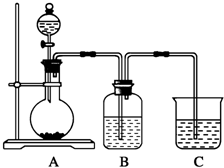 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间的10个纵行的元素都是金属元素 | |
| C. | 非极性键也可能存在于离子化合物中 | |
| D. | 双原子分子中的共价键,可能是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com