
| 实验变量 实验序号 | 银氨溶液的量/mL | |||
| 1 | ||||
| 2 |
分析 (1)银镜反应的方程式书写,只有-CHO和2molAg(NH3)2OH反应,配平方法:1mol-CHO和2molAg(NH3)2OH反应;
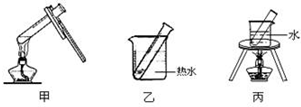
(2)根据影响银镜产生的效果角度分析,为了受热均匀,采用热水浴加热;
(3)根据单一变量研究方法,保证温度为变量,其它量相同;
(4)用稀硝酸除去银,再用水清洗;
(5)银镜的光亮程度与反应条件有关.
解答 解:(1)银镜反应的方程式书写,只有-CHO和2molAg(NH3)2OH反应,其它结构不变;配平方法:1mol-CHO和2molAg(NH3)2OH反应,反应的方程式为CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(2)加热时试管抖动或试管中液体沸腾都将影响银镜产生的效果,为了受热均匀,采用热水浴加热,装置乙符合要求,
故答案为:乙;
(3)究银氨溶液的温度对丙醛的银镜反应生成速率的影响,只能将温度定位变量,故答案为:
| 实验变量 实验序号 | 丙醛的量/滴 | 温度 /℃ | 出现银镜的时间/min | |
| 1 | ||||
| 2 |
点评 本题考查乙醛的银镜反应,侧重于除油污、保证银镜的生成、化学方程式的书写、乙醛进行银镜反应的最佳实验条件探究,银氨溶液废液的处理等,题目难度中等,注意银镜反应实验成功的关键因素.对比实验、银镜反应的实验条件、各条件对反应速率的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
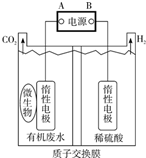 在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )| A. | 电极A为负极 | |
| B. | 电解中生成的CO2与H2物质的量之比为1:1 | |
| C. | 阳极反应为:CH3COOH一8e-+8OH-═2CO2↑+6H2O | |
| D. | 电解前后,阴极室的pH几乎保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
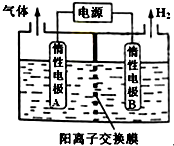 利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )| A. | B极区电解质溶液为LiOH溶液 | |
| B. | 阳极电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 电解过程中主要是H+通过阳离子交换膜向B电极迁移 | |
| D. | 电极A连接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯、裂化汽油、溴苯、福尔马林 | |
| B. | 乙醇、乙酸、乙醛、乙苯 | |
| C. | 苯甲酸溶液、甘油、甲苯、甲酸 | |
| D. | 苯酚、苯乙烯、苯、1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
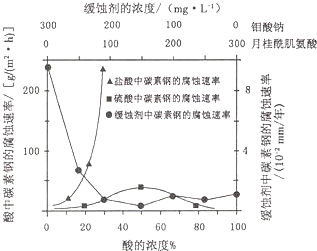
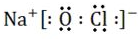 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$Na2CO3(s) | B. | CuCl2$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{葡萄糖}$Cu | ||
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | D. | MgO(s)$\stackrel{HNO_{3}(aq)}{→}$Mg(NO3)2(aq)$\stackrel{电解}{→}$Mg(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | Y>Z>X | D. | Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
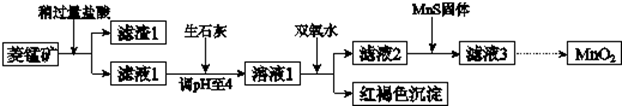
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com