
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
分析 A.利用太阳光能制氢气,是光能转化为化学能;
B.催化剂不能改变反应热的大小;
C.该反应的焓变大于0,为放热反应;
D.根据盖斯定律,目标反应CH4(g)═C(s)+2 H2(g)相当于②-③.
解答 解:A.太阳光催化分解水制氢气,是光能转化为化学能,故A错误;
B.催化剂不能改变反应热的大小,则反应②使用催化剂,△H2不变,故B错误;
C.反应的△H3=131.3kJ•mol-1>0,该反应为吸热反应,反应物的总能量小于生成物的总能量,故C错误;
D.根据盖斯定律,将热化学方程式②-③可得:CH4(g)═C(s)+2 H2(g)△H=△H2-△H3=206.1kJ•mol-1-131.3kJ•mol-1=+74.8kJ•mol-1,故D正确;
故选D.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握反应热与焓变之间的关系,B为易错点,注意催化剂不影响反应热.


科目:高中化学 来源: 题型:实验题
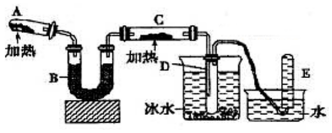 己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
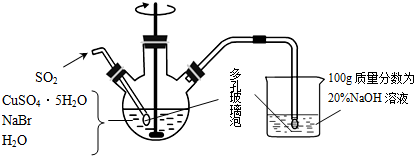
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

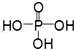 )
)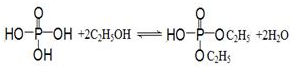 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 三氯化铁溶液跟过量氨水反应Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com