
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的铁粉加入稀硝酸中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe2+ |
| B | AlCl3溶液中滴加过量的氨水 | 先出现白色沉淀,后沉淀又逐渐溶解 | 氢氧化铝能溶于氨水 |
| C | 铝箔插入稀硝酸中 | 无明显现象 | 铝箔表面被稀硝酸氧化形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓硫酸点到pH试纸上 | 试纸变黑色 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 欲配制1000mL 0.1mol•L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线2cm时,再用胶头滴管加水至刻度线 | |
| B. | 将准确量取的18.4mol•L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线,即可制得100mL稀硫酸 | |
| C. | 仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 | |
| D. | 将氢氧化钠固体放在有滤纸的天平托盘上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
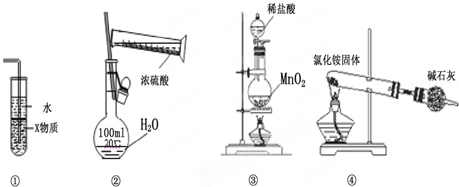
| A. | 装置中①X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| B. | 装置②可用于实验室配制一定物质的量浓度的稀硫酸 | |
| C. | 实验室用装置③制取氯气 | |
| D. | 实验室用装置④制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的平均反应速率是0.010 mol•L-1•s-1 | |
| B. | 容器中含D物质的量至少为0.45 mol | |
| C. | 容器中A的物质的量一定增加了0.30 mol | |
| D. | 容器中A、B、C、D的物质的量的比一定是4:5:4:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
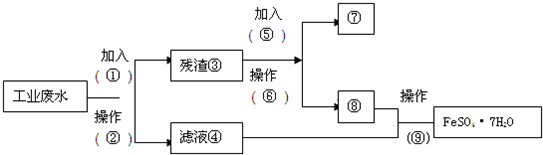
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g | B. | 58.8g | C. | 22.4g | D. | 53.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com