
【题目】在5mL0.02mol/L某金属氯化物(MCln)溶液中,滴加0.05mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( ) 
A.+1
B.+2
C.+3
D.+4
【答案】C
【解析】解:根据化学式知,某金属氯化物(MCln)溶液中n(Cl﹣)=0.02mol/L×0.005L×n=10﹣4 mol,当二者完全完全反应时消耗的硝酸银溶液体积为6mL,此时n(Cl﹣)=n(Ag+)=n(AgNO3)=0.05mol/L×0.006L=0.0003mol,则n=3,则该化合物化学式为MCl3 , 则M化合价为+3价,故选C.
根据化学式知,某金属氯化物(MCln)溶液中n(Cl﹣)=0.02mol/L×0.005L×n=10﹣4 mol,当二者完全完全反应时消耗的硝酸银溶液体积为6mL,此时n(Cl﹣)=n(Ag+)=n(AgNO3)=0.05mol/L×0.006L=0.0003mol,则n=3,据此计算金属元素化合价.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 医用酒精的浓度通常是95%
B. 蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)

① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
【答案】 ③ ② ① ④ AlCl3 NaOH 0.5
【解析】(1)水易挥发,海水中提取水可用蒸馏的方法,答案选③;从 KCl溶液中获取KCl晶体,可用蒸发的方法,答案选②;CaCO3不溶于水,分离CaCO3和水,可用过滤的方法,答案选①;植物油和水互不相溶,分离植物油和水,可用分液的方法,答案选④;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,发生反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为![]() =0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
=0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
【题型】综合题
【结束】
18
【题目】(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是________________________
继续滴加NaOH溶液至过量,现象是_______________。
(2)钠与水反应的离子方程式为_______________,该反应中氧化剂是_______________,产生1mol H2时,转移电子的物质的量为_______________mol。
(3)经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
①该反应的氧化剂是_______,被氧化的是_________元素。
②若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA
B.通常状况下,8g O2和O3的混合气体含有的分子数是0.5NA
C.常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl﹣ 个数为0.4NA
D.标准状况下,11.2L He分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A. 都是氧化还原反应 B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同 D. 生成KCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离提纯中除杂剂及相应的化学方程式分别为
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | ||
(ii)铁粉中混有铝粉 | ||
(iii)Al2O3中混有Al(OH)3 | ||
(iv)FeCl3溶液中混有FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中碘元素的检验可经过以下四个步骤完成(已知H2O2在酸性条件下能将海带中的I氧化成I2 , I2遇淀粉变蓝),各步骤中选用的实验用品不正确的是( ) 
A.将海带剪碎后灼烧成灰,选用①、②和⑨
B.将海带灰加蒸馏水溶解,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.取滤液,先加入几滴稀硫酸,再滴加H2O2 , 最后滴加淀粉溶液,选用③和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy , 则( ) 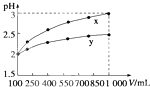
A.x为弱酸,Vx<Vy
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy
D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的( )
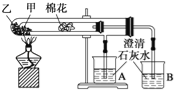
A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com