
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是( )
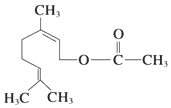
①在Ni催化条件下,1mol该有机物最多可与3mol H2发生加成反应
②该有机物能发生取代、加成、水解、缩聚反应
③该有机物分子式为C12H20O2
④该有机物的同分异构体可能为醇类,不可能为酚类
⑤1mol该有机物水解时只能消耗1mol NaOH
A. ②③④B. ③④⑤C. ②③⑤D. ①②③
科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
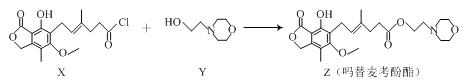 +HCl
+HCl
下列叙述正确的是
A. 用溴水可鉴别化合物X和ZB. 化合物Y的分子式为C6H14NO2
C. 化合物Z中含有手性碳原子D. 1mol化合物Z可以与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL 0.10 mol·L-1的 AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是( )
A. 最终得到白色沉淀和无色溶液
B. 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C. 在最终得到的溶液中,Cl—的物质的最为0.02 mol
D. 在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O)的工业流程如图。已知:①草酸钴晶体难溶于水,②RH为有机物(难电离)
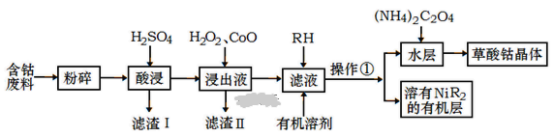
(1)滤渣I的主要成分是_____________(填化学式) ,写出两种能提高酸浸速率的措施_____________ 、 ___________。
(2) 操作①用到的主要仪器有___________________。
(3) H2O2是种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________________________________。
(4)加入氧化钴的目的是______________________________。
(5)加入(NH4)2C2O4反应得到草酸钴晶体的离子方程式________________________________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是__________________________________________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-) ,测定溶液中C2O42-的浓度, KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___________(填“偏高”、“偏低“或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( )
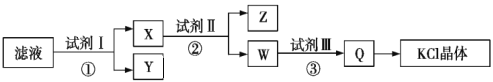
A.初始滤液显酸性
B.试剂Ⅰ为Ba(NO3)2溶液
C.步骤②中加入试剂Ⅱ的目的是除去Ba2+
D.图示步骤中的2次过滤操作不可以合并
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量的铝铁合金与1000mL一定浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4.00mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
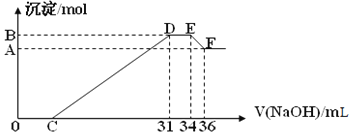
(1)原混合物中铝粉与铁粉的物质的量之比为______
(2)硝酸溶液的物质的量浓度为______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列说法中正确的是( )
A.18g水中含有的氢原子数目为NA
B.1 mol氩气分子所含的原子数目为2NA
C.106g碳酸钠中含有的钠离子为2NA
D.含0.5 mol HNO3的硝酸溶液中含有的氧原子为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料](NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)

实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________;
(2)滴定前,下列操作的正确顺序是_________(填字母编号);
a.盛装0.2000mol/L NaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol,
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________;
(5)装置B内溶液吸收的气体是____________;
(6)(NH4)2SO4在400℃分解的化学方程式是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com