
(14分)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下,将足量的SO2气体通入①的溶液中,即有保险粉生成,同时生成一种气体。
(1)写出NaOH的电子式
(2)制备SO2时所选用的酸,你认为下列最适宜选用的是
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
(1) 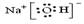 (2) B
(2) B
(3) NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O(写HCOOH且配平没问题,也给分)
(4) 0.1
(5) S2O32-+2H+=SO2+S↓+H2O 2 Na2S2O4 = Na2S2O3+Na2SO3+SO2
(6) 取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②
(或取少许固体溶于水中,若闻到刺激性气味,则证明是②)
解析试题分析:(1)NaOH的电子式为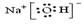 ;(2)制备SO2时所选用的酸,A、用浓盐酸 制得的二氧化硫中含有氯化氢,错误;B、用质量分数为70%的H2SO4制二氧化硫,可减少二氧化硫的溶解损失,有利于二氧化硫逸出,正确;C、稀硝酸能将二氧化硫氧化,错误;D、用质量分数为10%的稀硫酸,二氧化硫溶解损失,错误;选B。(3)根据题意知,制备保险粉的原理为二氧化硫、甲酸钠和氢氧化钠反应生成保险粉,化学方程式可表示为NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O;(4)保险粉除去酸性废水中的重铬酸根离子(Cr2O72-被转化为Cr3+)的反应方程式为:6H++Cr2O72-+ S2O42—="=" 2Cr3++ 2SO42—+3 H2O,则每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为0.1mol;(5)根据题意知,甲溶液为Na2S2O3溶液,向其中加入稀硫酸后生成硫酸钠、单质硫、二氧化硫和水,发生反应的离子方程式为S2O32-+2H+=SO2+S↓+H2O;保险粉分解生成硫代硫酸钠、亚硫酸钠和二氧化硫,化学方程式为2 Na2S2O4 = Na2S2O3+Na2SO3+SO2;(6)保险粉在空气中容易吸收氧气而发生氧化。若发生反应②:2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4,产物为NaHSO3和NaHSO4的混合物。要证明氧化时发生的是②的反应,可检验有硫酸根生成,实验方案为:取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②;也可利用H++HSO3—==H2O+SO2↑设计实验,实验方案为:取少许固体溶于水中,若闻到刺激性气味,则证明是②。
;(2)制备SO2时所选用的酸,A、用浓盐酸 制得的二氧化硫中含有氯化氢,错误;B、用质量分数为70%的H2SO4制二氧化硫,可减少二氧化硫的溶解损失,有利于二氧化硫逸出,正确;C、稀硝酸能将二氧化硫氧化,错误;D、用质量分数为10%的稀硫酸,二氧化硫溶解损失,错误;选B。(3)根据题意知,制备保险粉的原理为二氧化硫、甲酸钠和氢氧化钠反应生成保险粉,化学方程式可表示为NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O;(4)保险粉除去酸性废水中的重铬酸根离子(Cr2O72-被转化为Cr3+)的反应方程式为:6H++Cr2O72-+ S2O42—="=" 2Cr3++ 2SO42—+3 H2O,则每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为0.1mol;(5)根据题意知,甲溶液为Na2S2O3溶液,向其中加入稀硫酸后生成硫酸钠、单质硫、二氧化硫和水,发生反应的离子方程式为S2O32-+2H+=SO2+S↓+H2O;保险粉分解生成硫代硫酸钠、亚硫酸钠和二氧化硫,化学方程式为2 Na2S2O4 = Na2S2O3+Na2SO3+SO2;(6)保险粉在空气中容易吸收氧气而发生氧化。若发生反应②:2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4,产物为NaHSO3和NaHSO4的混合物。要证明氧化时发生的是②的反应,可检验有硫酸根生成,实验方案为:取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②;也可利用H++HSO3—==H2O+SO2↑设计实验,实验方案为:取少许固体溶于水中,若闻到刺激性气味,则证明是②。
考点:以保险粉的制备和应用为载体考查电子式、化学方程式的书写,二氧化硫的制备,氧化还原的计算及实验方案的设计、评价。


科目:高中化学 来源: 题型:单选题
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
| A.CaO2具有氧化性,对面粉可能具有增白作用 |
| B.CaO2中阴阳离子的个数比为1:1 |
| C.CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
| A.R3O4,RO,2 :1 | B.RO2,RO, 1:3 |
| C.RO2,R3O4 ,1 : 2 | D.RO2,RO,1 : 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12 分)(原创)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6高温3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
| A.Al是还原剂 | B.氧化产物只有KAlF4 |
| C.每转移6NA电子,得到42 g Si | D.Al元素在KAlF4和K2AlF5中化合价不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁能在稀硝酸中溶解: →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O
24.在上述方程式上标出电子转移的方向和数目。
25.该反应中被还原的元素是 ,还原剂是 。
26.若有0.1 mol铁参加反应,被还原的HNO3为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。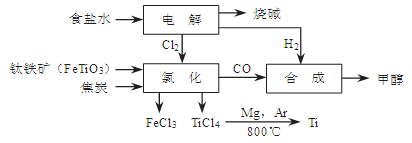
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)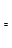 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 。图中t3时改变的条件可能是 。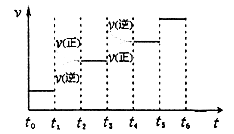
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: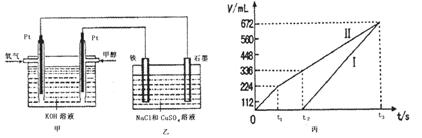
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式 。
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)等物质的量的下列化合物与足量浓盐酸反应,得到氯气的物质的量最多的是
________(填序号)。
已知:MnO4-+H++Cl-―→Mn2++Cl2↑+H2O(未配平)
ClO3-+H++Cl-―→Cl2↑+H2O(未配平)
ClO-+H++Cl-―→Cl2↑+H2O(未配平)
A.KClO3 B.KMnO4 C.MnO2 D.Ca(ClO)2
(2)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是________(填序号)。
A.3Cl2+6FeI2=2FeCl3+4FeI3
B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-=2Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com