
【题目】下列卤代烃在KOH醇溶液中加热不反应的是
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥ B. ②③⑤ C. 全部 D. ②④
【答案】A
【解析】
①有机物发生消去反应发生后将会形成不饱和键,而氯苯中相邻的碳原子是苯环的一部分,若消去再形成双键破坏苯环结构,故不能发生消去反应,故①正确;②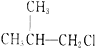 和氯相连的碳的相邻碳原子上有氢,故能消去,生成对应的烯烃和氯化钾,故②错误;③(CH3)3CCH2Cl和氯相连的碳的相邻碳原子上没有氢,所以不能发生消去反应。故③正确;④CHCl2CHBr2和氯或溴相连的碳相邻碳原子上有氢,故能消去,生成对应的烯烃或炔烃和氯化钾,故④错误;⑤
和氯相连的碳的相邻碳原子上有氢,故能消去,生成对应的烯烃和氯化钾,故②错误;③(CH3)3CCH2Cl和氯相连的碳的相邻碳原子上没有氢,所以不能发生消去反应。故③正确;④CHCl2CHBr2和氯或溴相连的碳相邻碳原子上有氢,故能消去,生成对应的烯烃或炔烃和氯化钾,故④错误;⑤![]() 和溴相连的碳上有氢,故能发生消去反应,生成对应的烯烃和氯化钾,故⑤错误;⑥CH3Cl只有一个碳,没有相邻的碳,所以不能发生消去反应。故⑥正确;故选A。
和溴相连的碳上有氢,故能发生消去反应,生成对应的烯烃和氯化钾,故⑤错误;⑥CH3Cl只有一个碳,没有相邻的碳,所以不能发生消去反应。故⑥正确;故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
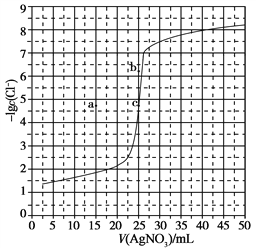
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
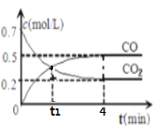
(1)t1时,正、逆反应速率的大小关系为ν正______ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=__________________;
(3)下列条件的改变能减慢其反应速率的是______________(选填序号)
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________________(选填序号)
①v(CO2)=v(CO)
②单位时间内生成n molCO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化
④容器中气体的平均分子量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
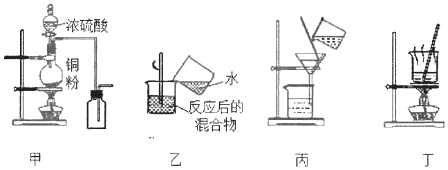
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光,装置如下。下列说法错误的是
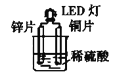
A.铜片表面有气泡生成B.装置中存在“化学能→电能→光能”的转换
C.电子由锌片→稀硫酸→铜片D.电解质溶液中,阳离子移向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾的化合物广泛存在于自然界中。回答下列问题:
(l)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_________形象化描述。
(2)钾的焰色反应为_____色,发生焰色反应的原因是__________________________________。
(3)叠氮化钾(KN3)晶体中,含有的共价键类型有_____________,N3-的空间构型为__________。
(4)CO能与金属K和Mn形成配合物K[Mn(CO)5],Mn元素基态原子的价电子排布式为______________。
(5)原子坐标参数可表示晶饱内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(l,0,0),则C原子的坐标参数为_____________。
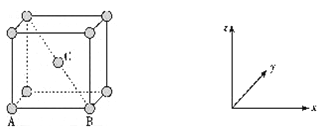
(6)钾晶体的晶胞参数为a pm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为____________pm,晶体钾的密度计算式是_____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知存在离子反应3S+6OH-=2S2-+SO32-+3H2O,关于该反应的说法正确的是
A. 该反应属于复分解反应
B. 该反应氢氧根离子作氧化剂
C. 该反应中氧化剂与还原剂的质量为2∶1
D. 每生成2个S2-反应转移的电子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com