
����Ŀ���ѡ�������������ͭ�Ƚ������仯�����ڹ�ҵ������Ҫ��;��
(1)�����Ͻ�����ϵ����Ͻ�Ĵ������úϽ���з����¶ȵ͡��۸����е��ŵ㡣
��Ti�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ________________��
��Fe�Ļ�̬ԭ�ӹ���________�ֲ�ͬ�ܼ��ĵ��ӡ�
(2)�Ʊ�CrO2Cl2�ķ�ӦΪK2Cr2O7��3CCl4===2KCl��2CrO2Cl2��3COCl2����
��������ѧ����ʽ�зǽ���Ԫ�ص縺���ɴ�С��˳����______________(��Ԫ�ط��ű�ʾ)��
��COCl2����������ԭ�Ӿ�����8���ӹ��ͣ�COCl2�����ЦҼ��ͦм��ĸ�����Ϊ____________������ԭ�ӵ��ӻ���ʽΪ____________��
(3)NiO��FeO�ľ���ṹ�����Ȼ��Ƶľ���ṹ��ͬ������Ni2����Fe2�������Ӱ뾶�ֱ�Ϊ6.9��10��2 nm��7.8��10��2 nm�����۵㣺NiO____________(�>������<������)FeO��
(4)Ni��La�ĺϽ���Ŀǰʹ�ù㷺�Ĵ�����ϣ����д����������������͵��µ��ص㣬���ձ����й���ʵ���˲�ҵ�����úϽ�ľ����ṹ��ͼ��ʾ��
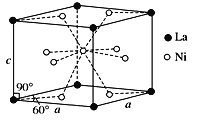
�ٸþ���Ļ�ѧʽΪ________________��
����֪�þ�����Ħ������ΪM g��mol��1���ܶ�Ϊd g��cm��3����NAΪ�����ӵ�������ֵ����þ����������____________cm3(�ú�M��d��NA�Ĵ���ʽ��ʾ)��
[��ѧ��ѡ��5���л���ѧ����]
���𰸡���15�֣�(1)��3d24s2��2�֣���7��2�֣�
(2)��O>Cl>C��2�֣���3��1��2�֣�sp2
(3)>��1�֣�(4)��LaNi5��2�֣���![]() ��2�֣�
��2�֣�
��������
�������: ��1����̬��ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d54s1���۵����Ų�ʽΪ3d54s1����Ϊ��3d54s1����2��1s2 2s2 2p6 3s2 3p6 3d6 4s2 �ɴ˿ɼ�,����7���ܼ�,ͬһ��������ĵ�����������ȵġ� ����,���Ļ�̬ ԭ ����7����������ͬ�ܼ��ĵ��ӡ�(2) ��O��C��Cl��Ϊ�ǽ������ǽ����Ի�縺�ԣ�O>Cl>C����COCl2��������1��C=O����2��C-Cl��������COCl2�����ЦҼ�����ĿΪ3���м�����ĿΪ1��������3��1����Ϊ��3��1��(3) Ni0��Fe0�ľ���ṹ���;����Ȼ��Ƶ���ͬ��˵�����߶������Ӿ��壬���Ӿ�����۵������Ӽ���ǿ���йأ��������������Խ�࣬���Ӱ뾶ԽС�����Ӽ�Խǿ���۵�Խ�ߣ�����Ni2+�����Ӱ뾶С��Fe2+�����Ӱ뾶�������۵���NiO��FeO����Ϊ������(4)����������һ����ԭ�ӡ�����8����ԭ�Ӷ��ھ������ϣ���ԭ���ھ������㣻��������ԭ��1��1+1/2��8=5����ԭ��8��1/8=1�����Ի�ѧʽΪ�� LaNi5��һ�����������Ϊm=M/NA; m=p��v; v=M/ NA��d;
����: �����ļ��㡢��ѧ������������Ų��������ܡ��縺�Եĺ��弰��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC3H9N���л��Nԭ������������������ԭ������, ����л�����ܵĽṹ���У������������칹��
A. 1�� B. 2�� C. 3�� D. 4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء������뻯ѧ��ص�˵����ȷ����
A. ˮ�ࡢˮ������ˮ�������ڹ����β�Ʒ
B. ҽ�þƾ���������ע��Һ���ö����ЧӦ����
C. ��ˮ��ʳ��ˮ����ɱ����ԭ����ͬ
D. �̬���ʺͲ�ľ�һ��ʹ�ûή�ͷ�Ч
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ӦN2+O22NO���ܱ������н��У����д�ʩ���ı仯ѧ��Ӧ���ʵ��ǣ� ��
A.��С���ʹѹǿ����
B.���ݣ�����N2
C.���ݣ�����He
D.��ѹ������He
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��F��F�����������У�����ͬ���ǣ� ��
�ٺ��������� �ں�������� ������������ �ܺ�����Ӳ�����
A.�٢�
B.�ڢ�
C.�ۢ�
D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����֬��������ȷ���� ( )
A. ��֬�й̶����ۡ��е�
B. ��֬�Ǹ�֬����ĸ�����
C. ��֬������ʹ������Ȼ�̼��Һ��ɫ
D. ��֬�ֳ��ͺ�֬�����͵��۵����֬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A���ѹ������Ƶ���ˮ�μӵ�ʯ����Һ�У���Һ��ɫ�ȱ�������ɫ
B������ˮ����������ˮ����������Ϊ������ˮ��Ӧ���ɵ�HClO����ǿ������
C��Cl2��Cl-���ж�
D��Cl2��HClO��H2O2������Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������������У�δ�漰������ԭ��Ӧ���ǣ� ��
A.�������
B.�ȼҵ
C.����ʯ��ʯ��ȡ��ʯ��
D.��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ؿ�ʼӦ��������Դ�����������ʹ�ú�缫���϶Ի���������һ����Σ���� ij�ͺ�����صĵ缫������Ni(OH)2��̼������������Ϳ�����������Ƴ����о�С���������¹����������Ըõ�صĵ缫���Ͻ�����Դ���գ�

��֪:��NiCl2������ˮ��Fe3+��������Ni2+��
��ʵ���¶�ʱ���ܽ��:NiC2O4> NiC2O4H2O> NiC2O42H2O
��ij�¶��£�Ksp[Ni(OH)2] = 5.0��10-16��Ksp[NiC2O4]=4.0��10-10��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Al(OH)3]=3.0��10-34
�����������⣺
��1����NiO������Һ��pH�����������ij�����__________�����������ֳ����ܹ���������������________(��������)��
��2���������õ��ij���Ϊ___________��ϴ��Ni(OH)3�����ķ�����__________��
��3��д������NaOH��Һ������Ӧ�����ӷ���ʽ_________���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=_________��
��4����������������ӦʽΪ___________���������ɱ�������ò���֮һ������д���������������ӷ���ʽ____________��
��5���������صĵ���ܷ�ӦΪFe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2���õ�صĵ��ҺΪ___________��������������������������Һ�����ʱ������������ӦʽΪ_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com