
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
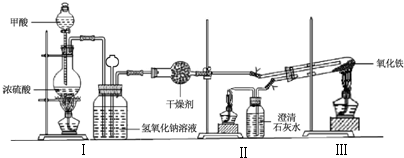
分析 (1)根据装置图可知甲酸盛放在分液漏斗中;HCOOH分解生成CO和水;
(2)CO与氧气混合加热易爆炸,所以点燃前要检验纯度;
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ出酒精灯;应最后熄灭II中酒精灯,目的是防止多余的一氧化碳进入空气中污染环境;
(4)酒精灯的火焰平均600度,不可能达到铁稳定存在的温度,但是,在实际操作过程中,由于受热及散热的问题,会出现局部温度较高的现象;
(5)Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100%、77.8%、70%、72.4%,结合表中的数据判断物质的组成;
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则$\frac{x×\frac{168}{232}+y}{x+y}$×100%=74.50%,据此计算
解答 解:(1)根据装置图可知甲酸盛放在分液漏斗中,则盛放甲酸的仪器名称为分液漏斗;在浓硫酸加热条件下,HCOOH分解可得CO,根据质量守恒可知另一个产物为水,反应的化学方程式为HCOOH$→_{加热}^{浓硫酸}$CO↑+H2O;
故答案为:分液漏斗;HCOOH$→_{加热}^{浓硫酸}$CO↑+H2O;
(2)CO与氧气混合加热易爆炸,所以点燃前要检验纯度,则实验步骤③某项操作是指检验CO纯度;
故答案为:检验CO纯度;
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ出酒精灯,是为了防止生成热的铁被空气中的氧气氧化;应最后熄灭II中酒精灯,目的是防止多余的一氧化碳进入空气中污染环境,故实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II;
故答案为:Ⅲ、I、II;
(4)当反应温度高于710℃,Fe能稳定存在,酒精灯的火焰平均600度,不可能达到铁稳定存在的温度,但是,在实际操作过程中,由于受热及散热的问题,长时间集中加热会出现局部温度较高的现象,达到还原生成铁所需要的温度;
故答案为:长时间集中加热使局部温度达到还原生成铁所需要的温度;
(5)Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100%、77.8%、70%、72.4%,酒精灯加热所得产物中Fe元素的百分含量为74.50%,混合物中至少有一个Fe元素含量大于74.50%,至少有一个Fe元素含量小于74.50%,故混合物中一定有Fe和FeO中的至少一种,也一定有Fe2O3和Fe3O4中的一种,
两种物质混合的有Fe和Fe2O3,Fe和Fe3O4,FeO和Fe2O3,FeO和Fe3O4 共4种组合,
三种物质混合的有Fe、Fe2O3和Fe3O4,FeO、Fe2O3和Fe3O4,Fe2O3、Fe和FeO,Fe3O4、Fe和FeO共4种组合,
四种物质混合的有Fe、FeO、Fe2O3和e3O4只有1种,共9种组合;
故答案为:9;
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则:$\frac{x×\frac{168}{232}+y}{x+y}$×100%=74.50%,
解得:$\frac{x}{y}$=12:1;
故答案为:12.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制450mL溶液需要用到450mL容量瓶 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上 | |
| D. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7 mol/L | B. | 8.5 mol/L | C. | 9.6 mol/L | D. | 10.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C平衡时的浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: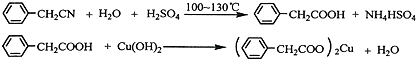
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
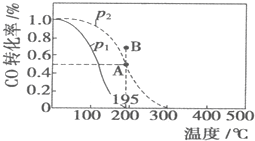 在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | P1>P2,a<0 | |
| B. | 在P2及195℃时,反应前3min的平均速率v(CH3OH)=0.08mol/(L•min) | |
| C. | 在P2及195℃时,该反应的平衡常数为25(mol/L)-2 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应的反应热测定需用温度计测量温度二次,分别为反应的起始温度和最高温度 | |
| B. | 用试纸检验气体时,可先把试纸用蒸馏水润湿,粘在玻璃棒一端,用玻璃棒把试纸放到盛待测气体的容器口附近 | |
| C. | 用剩的药品能否放回原瓶,应视具体情况而定 | |
| D. | 将铂丝放在盐酸中洗涤并灼烧为无色后,再蘸取待测物进行焰色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com