
反应CH3OH (l)+NH3(g)====CH3NH2(g)+H2O(g)在某 温度自发向右进行,若反应|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ· mol-1,则下列正确的是( )
温度自发向右进行,若反应|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ· mol-1,则下列正确的是( )
A.ΔH >0,ΔH-TΔS<0
B.ΔH <0,ΔH-TΔS>0
C.ΔH >0,ΔH-TΔS>0
D.ΔH <0,ΔH-TΔS<0
科目:高中化学 来源: 题型:
某密闭容器中存在2NO+O2 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
A.该反应的正反应是吸热反应。
 B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
C.T1时,当反应处于D点,则该反应的逆反应速率
大于正反应速率。
D.如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的
曲线在原曲线上方。
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO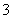 ,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
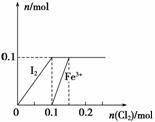
A.氧化性强弱:I2<Fe3+<IO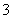
B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I-+6Cl2===5I2+2Fe3++12Cl-
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I-+3Cl2===2I2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
能够充分说明在恒温恒容下的密闭容器中,反应2SO2(g)+O2(g) 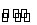
2SO3(g)已达平衡状态的标志是( )
A.容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B.SO2和SO3的物质的量浓度相等
C.反应容器内压强不随时间变化而变化
D.单位时间内生成2 mol SO3的同时生成1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于酯类说法正确的是( )
A.乙酸乙酯和甲醛最简式相同
B.酯类都能发生水解反应
C.酯在酸性条件下水解程度比在碱性条件下大
D.只有有机酸和醇才能反应生成酯
查看答案和解析>>
科目:高中化学 来源: 题型:
已知醛或酮可与格氏试剂(R′MgX)发生加成反应,所得产物经水解可得醇:
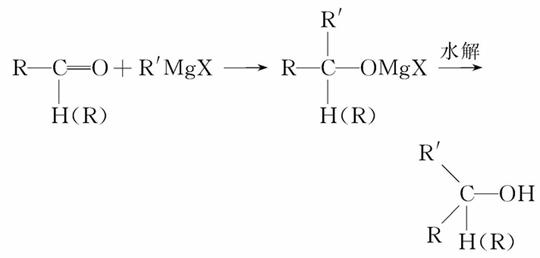
若用此种方法制取HOC(CH3)2CH2CH3,可选用的醛或酮与格氏试剂是( )
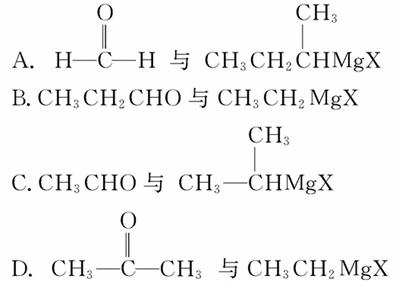
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应中,平衡常数与反应进行的限度的关系正确的是( )
A.K越大,反应程度越大
B.K越大,反应程度越小
C.K的大小与反应程度无关
D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
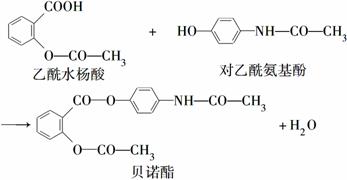
下列有关叙述正确的是( )
A.贝诺酯分子中有三种含氧官能团
B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D.贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com