
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快是
A.V(H2)==0.1 mol/(L·min)B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)D.V(N2)==0.02mol/(L·s)
科目:高中化学 来源: 题型:
【题目】下表列出了a~m 13种元素在周期表(已省略了过渡元素)中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | a | |
2 | b | c | d | |||||
3 | e | f | g | h | i | |||
4 | j | k | l | |||||
5 | m |
(1)元素b为________(填名称);画出g的原子结构示意图__________。
(2)元素f、i、j的原子半径从大到小的顺序是____________(用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是_____________(用离子符号表示)。
(3)h和k的原子序数相差___________(填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为___________,该化合物中化学键有____________,该化合物与c的最高价氧化物反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
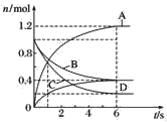
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列相关问题:
(1)基态氮原子的电子排布式为____,碳、氮、氧元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)NH4Cl中阳离子的空间构型为______,与NH4+互为等电子体的一种非极性分子的化学式为________。
(3)NH4Cl受热易分解产生氨气,向CuSO4溶液中通入氨气至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,该溶液中存在的配离子的结构式为_______(配位键用→表示)。
(4)GaAs与GaN均为原子晶体,GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_______。已知GaAs的密度为ρ g/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,阿伏伽德罗常数的值为NA,则GaAs晶胞中Ga之间的最短距离为_______pm(写出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,可以由废旧锂钴电池正极材料(主要含Fe、Al、硅等杂质)回收钴,再用电化学法制得CoFe2O4。其流程如图所示(过程中所加试剂均足量)
Ⅰ.废旧电池中钴的回收
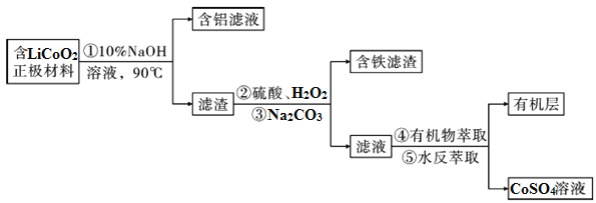
(1)含铝滤液中,铝元素的存在形式为________(写化学式);硅在过程_____(填序号)与钴分离。
(2)写出过程②中LiCoO2与H2O2发生反应的化学方程式____________________________。
(3)过程③Na2CO3的主要作用为________________________________________。
Ⅱ.电解法制得钴铁合金
(4)配制 0.050molL-1 FeSO4和0.025molL-1 CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为____________________________________。
Ⅲ.阳极氧化法制得钴铁氧体
(5)以1.500molL1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________。
(6)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为______________________________________________。
(7)由废旧锂钴电池制CoFe2O4的现实意义在于:______________________(写一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+ = AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C. 苯酚钠溶液通入少量CO2:![]()
D. 实验室用液溴和苯在催化剂作用下制溴苯: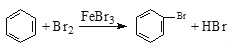
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
A.①③④⑤B.①④⑤C.③④⑤D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
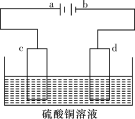
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是同学们熟悉的物质:
①![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;⑩NaOH
;⑩NaOH
(1)这些物质中,属于共价化合物的是______![]() 填序号,下同
填序号,下同![]() ;只含有离子键的是______;不含化学键的是______。
;只含有离子键的是______;不含化学键的是______。
(2)写出下列物质的结构式![]() ______;
______;![]() ______。
______。
(3)写出下列物质的电子式![]() ______;⑩NaOH______。
______;⑩NaOH______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com