
用密度为ρ1g/cm3,质量分数是ω的浓盐酸,配制成体积比为1:4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度为( )
A.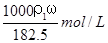 B.
B.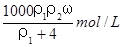
C.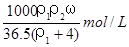 D.
D.
科目:高中化学 来源: 题型:
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 7 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
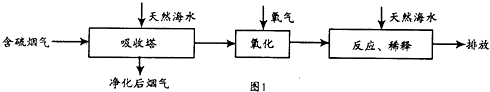
| 实验序号 | 温度(K) | 含硫烟气SO2浓度(10-6mol.l-1) | 脱硫率(%) |
| Ⅰ | 298 | 400 | 99.5 |
| Ⅱ | T | 500 | 97.1 |
| Ⅲ | 313 | 400 | 94.3 |
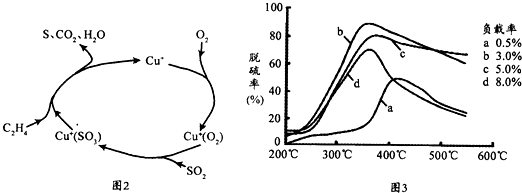
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式
____________________ 。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积/mL | 0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点
是 。
②步骤二中设计色阶序号1的作用
是 。
③如果水样显色后比6号还深,应采取的措施
是 。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm-3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3 === NO3- + H+ + H2O 6NO3-+ 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇 g。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式____________________ 。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积/mL | 0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 |
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点是 。
②步骤二中设计色阶序号1的作用是 。
③如果水样显色后比6号还深,应采取的措施是 。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm-3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2+ NH3 === NO3- +H+ + H2O 6NO3-+6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇 g。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三12月联考化学试卷 题型:填空题
(14分)含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式____________________ 。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
|
色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
|
加入溶液B的体积/mL |
0.0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
|
反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点是 。
②步骤二中设计色阶序号1的作用是 。
③如果水样显色后比6号还深,应采取的措施是 。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm-3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3 === NO3- + H+ + H2O 6NO3-+ 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com