
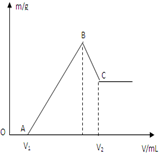
 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.
将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.分析 (1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为:Al(OH)3+OH-=AlO2-+2H2O;
(2)由图可知,0~V1发生H++OH-=H2O,V1~B发生Mg2+、Al3+转化为沉淀的反应,B→C段发生Al(OH)3+OH-=AlO2-+2H2O,结合反应及原子守恒计算解答;、(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用400mL1mol•L-1盐酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,再结合n(Mg)+n(Al)=0.1mol判断a的范围;
(4)滤液中含有偏铝酸钠,加入二氧化碳后反应生成氢氧化铝沉淀,会观察到有白色胶状沉淀生成.
解答 解:由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O,
(1)根据分析可知,BC过程的离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)若V1=140mL,说明盐酸有剩余,剩余盐酸的物质的量=1mol/L×0.14L=0.14mol,则和金属反应的盐酸的物质的量=4mol/L×0.1L-0.14mol=0.26mol,
(2)设镁的物质的量是x,铝的物质的量是y,x+y=0.1、2x=3y=0.26,解得:x=0.04mol,y=0.06mol,
V2时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.06mol+0.4mol=0.46mol,所以氢氧化钠的体积=$\frac{0.46mol}{1mol/L}$=460mL,
故答案为:0.04;460;
(3)溶液中的Mg2+和Al3+刚好沉淀完全时,溶液中溶质为NaCl,则n(NaOH)=n(HCl)=4mol/L×0.1L=0.4mol,需要氢氧化钠溶液的体积为:$\frac{0.4mol}{1mol/L}$=0.4L=400mL,
故答案为:400;
(4)若混合物仍为0.1mol,其中镁的物质的量分数为a,用400mL1mol•L-1盐酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400mL,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,
故答案为:0.5≤a<1;
(5)当加入V2mlNaOH溶液后过滤,滤液中含有偏铝酸钠,向滤液中通入过量的CO2气体后发生反应:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,所以会观察到有白色胶状沉淀生成,
故答案为:白色胶状沉淀;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评 本题以图象形式考查混合物计算,题目难度中等,明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,可以使计算简化.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨 | B. | D2与H2 | ||
| C. | CO与CO2 | D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
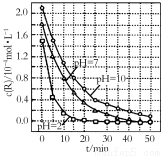
A.R的起始浓度越小,降解速率越大
B.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
C.溶液酸性越 强,R的降解速率越小
强,R的降解速率越小
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在转移液体前容量瓶中有少量蒸馏水 | |
| B. | 定容摇匀后,液面已低于容量瓶刻度线,此时再加水 | |
| C. | 转移时有少许液体沿容量瓶外壁流到实验桌上 | |
| D. | 定容时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将乙醇与浓的氢溴酸混合加热可以制备溴乙烷 | |
| D. | 做过银镜反应实验的试管内壁附着银,用稀氨水可以洗去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com