
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
操作步骤 | 实验现象 | 结论 |
①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
100mL3mol/LH2SO4溶液跟过量铁粉反应,在一定温度,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.硫酸钾溶液 B.1mol/LH2SO4溶液 C.碳酸钠固体 D.金属镁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上开学测化学试卷(解析版) 题型:选择题
下列措施肯定能使反应速率增大的是( )
A.增大反应物的量 B.增加压强 C.适当升高温度 D.降低反应物浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:选择题
分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )
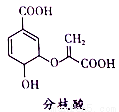
A.1mol分枝酸最多可与3molNaOH发生中和反应
B.可与乙醇、乙酸反应,且反应类型相同
C.分子中含有2 种官能团
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色.且原理相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:选择题
下列各化合物中,阳离子与阴离子半径之比最小的是( )
A. LiI B. LiF C. NaCl D. KBr
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
己知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-a kJ·mol-l
②CH4(g) +2O2 (g) =CO2 (g) +2H2O(g) △H=-b kJ·mol-l
⑧CH4(g) +2O2 (g) =CO2 (g) +2H2O(1) △H=-c kJ·mol-l
则下列叙述正确的是
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ/mol
C.2CH3OH (g) =2CH4(g)+O2(g) △H=2(b-a) kJ·mol-l
D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O (1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:填空题
合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)?2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。


(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
B | 取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体 | Na2O2没有变质 |
C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有水解 |
D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com